Сера – это химический элемент, известный человечеству с древних времен. Это ярко-желтое вещество, обладающее характерным запахом. Одной из особенностей серы является то, что она плохо растворяется в воде. Это означает, что при попадании серы в воду она не превращается в раствор, а остается в виде частиц.
Главной причиной нерастворимости серы в воде является ее молекулярное строение. Молекулы серы состоят из атомов, которые между собой связаны ковалентными связями. Такие связи являются очень прочными и обеспечивают хорошую устойчивость серы. Именно благодаря своей структуре сера обладает такими уникальными свойствами, как высокая термическая и химическая устойчивость.
Также следует отметить, что вода – это полярное вещество, а сера – это неполярное вещество. Полярные вещества, такие как вода, хорошо растворяются друг в друге благодаря межмолекулярным взаимодействиям положительно и отрицательно заряженных частей молекул. В случае с серой и водой подобных взаимодействий не происходит, что приводит к нерастворимости серы в воде.
Сера: свойства и особенности взаимодействия с водой

Основная причина заключается в химической структуре молекулы серы. Молекула серы состоит из двух атомов, которые связаны сильной двойной связью. Эта связь очень стабильна и требует большого количества энергии для разрыва. Вода, в свою очередь, не обладает достаточной реактивностью для разрыва связей в молекулах серы.
Кроме того, сера обладает гидрофобными свойствами, что означает, что она отталкивается водой. Это свойство обусловлено присутствием у серы большого количества неполярных связей. Вода же является полярным растворителем, то есть молекулы воды имеют электрический заряд и образуют полярные связи. Из-за различий в полярности молекул, сера и вода не взаимодействуют между собой.
Также стоит отметить, что растворение серы в воде чрезвычайно медленный процесс. Для полного растворения серы в воде требуется очень большое количество времени и энергии. Это объясняется высокой стабильностью связей в молекуле серы и низкой активностью серы в отношении воды.
Несмотря на то, что сера не растворяется в воде, она может реагировать с ней при высоких температурах и в определенных условиях. Например, при нагревании серы с водой образуется диоксид серы (SO2) и сероводород (H2S). Эта реакция особенно активна при наличии катализаторов или при использовании высоких давлений.
Строение и химические свойства серы
Строение серы состоит из молекул, состоящих из восьми атомов серы. Эти молекулы образуют кристаллическую решетку, что делает серу твердым веществом при комнатной температуре и давлении. Кристаллическая структура обеспечивает сере устойчивость и инертность.
Вода – это поларное растворителе, в то время как сера является неполярным веществом. Полярность воды обусловлена ее молекулярной структурой, в которой атомы водорода и кислорода разделены неравномерно. Это приводит к образованию положительно и отрицательно заряженных частей молекулы воды – диполя. В результате образуются водородные связи между молекулами воды.
Таким образом, сера не растворяется в воде из-за несоответствия полярности серы и воды. Молекулы серы не обладают полярными зарядами и не могут образовывать водородные связи с молекулами воды. В результате, сера остается в нерастворенном состоянии в воде, образуя отдельные капли или кристаллы.
| Свойство | Описание |
|---|---|
| Цвет | Желтый |
| Плотность | 2.07 г/см³ |
| Температура плавления | 115.21 °C |
| Температура кипения | 444.6 °C |
| Растворимость в воде | Не растворяется |
Взаимодействие серы с водой

Вода является полярным растворителем, а сера - неполярным веществом. Полярные растворители, такие как вода, имеют частичный заряд и способны взаимодействовать с другими полярными или ионными веществами. Неполярные вещества, такие как сера, не имеют заряда и не могут образовывать стабильные взаимодействия с полярными растворителями.
Когда сера попадает в контакт с водой, ее молекулы остаются в неполярной форме и не могут вступать во взаимодействие с полярными молекулами воды. В результате, сера остается в нерастворимом виде и образует мелкие кристаллы, которые можно наблюдать в воде в виде осадка или взвеси.
Не растворяющаяся в воде природа серы обусловливает ее особые свойства и применение. Сера используется в различных отраслях промышленности, включая производство пластиков, резиновых изделий, лекарственных препаратов и удобрений. Ее нерастворимость в воде позволяет использовать серу в качестве изоляционного материала и для создания герметичных покрытий.
Процесс растворения серы в воде
Когда кристаллы серы попадают в контакт с молекулами воды, происходит взаимодействие между ними. Однако, это взаимодействие слабое и не приводит к полному растворению серы в воде. В отличие от некоторых других веществ, сера не образует ионы при растворении.
В результате процесса растворения серы в воде образуется коллоидное растворение, в котором кристаллы серы распределены неравномерно в воде и такие крупные частицы едва заметны для глаза.
Это объясняется дисперсионными силами, которые действуют в системе серы и воды. Дисперсионные силы не достаточно сильные, чтобы преодолеть прочные связи между атомами серы и разорвать их. Поэтому, водные молекулы окружают кристалл серы, но не могут вступить во взаимодействие с его структурой достаточно сильно, чтобы разрушить ее.
В связи с этим, основное количество серы остается в форме нерастворенных кристаллов, прикрепленных к водным молекулам. Именно поэтому сера не растворяется в воде полностью и образует коллоидное решение.
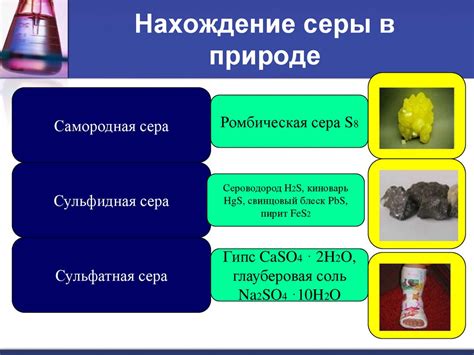
Сера и сульфиды в природе

Сера обнаруживается в природе в различных формах, включая серу, сульфаты, сульфиды и сероводород. Сера в основном образуется в результате геологических процессов, таких как вулканические извержения. Она может также образовываться в результате бактериального разложения органического материала, содержащего серу.
| Форма серы | Описание |
|---|---|
| Сера | Желтые кристаллы или аморфный порошок |
| Сульфаты | Соединения серы с кислотами и металлами |
| Сульфиды | Соединения серы с металлами |
| Сероводород | Газ с запахом гнили, содержащий серу |
Сульфиды – важная группа минералов, которые содержат серу в своем составе. Они широко распространены как в подземных, так и в поверхностных отложениях. Некоторые из наиболее распространенных сульфидов включают пирит, гальенит и цинксульфид. Содержание серы в сульфидах может быть высоким или низким, в зависимости от конкретного соединения.
Вода обычно не растворяет серу, так как межмолекулярные силы воды не взаимодействуют с атомами серы. Это делает серу нерастворимой в воде. Однако, некоторые сульфиды, такие как сербитюрат, могут растворяться в воде, если они находятся в определенной форме или имеют определенные свойства.
Практическое применение свойств серы и ее взаимодействия с водой

Сера известна своими уникальными химическими и физическими свойствами, которые делают ее незаменимым веществом во многих отраслях промышленности и научных исследований.
Одно из практических применений серы - производство серной кислоты (H2SO4). Для этой цели сера сначала сжигается, образуя диоксид серы (SO2), который затем окисляется до трехвалентной серы (SO3). Полученный трехвалентный оксид серы реагирует с водой, образуя серную кислоту, которая широко применяется в производстве удобрений, красителей, пластмасс и других продуктов.
Еще одним практическим применением свойств серы является производство каучука. Добавление серы к нерезиновым полимерам приводит к их вулканизации. В результате образуются сети кросс-связей между молекулами полимера, что делает каучук эластичным и устойчивым к разрывам. Это свойство широко используется в производстве шин, резиновых изделий и других материалов, которые нуждаются в прочности и гибкости.
Кроме того, сера применяется в процессе получения однополюсных транзисторов и полупроводников, играющих важную роль в электронике и вычислительной технике. В этом случае сера вступает во взаимодействие с другими химическими элементами, создавая контакты и структуры, необходимые для передачи электрического сигнала.
Таким образом, свойства серы и ее взаимодействие с водой находят широкое практическое применение в различных сферах человеческой деятельности, от промышленности до науки.