Барийсульфат (BaSO4) - это неорганическое соединение, которое обладает особой нерастворимостью в воде. Это свойство привлекает внимание ученых уже множество лет. Несмотря на то, что вода является одним из самых распространенных растворителей, BaSO4 остается недоступным для него. Это явление требует более тщательного изучения, чтобы понять его причины и механизмы.
Запомните принцип "подобное растворяется в подобном". Обычно, если вещество является полярным и обладает молекулярной структурой, оно будет лучше растворяться в других полярных растворителях. Однако BaSO4 - это исключение из этого правила. Это соединение обладает высокой полярностью, но не растворяется в воде, которая также является полярной.
Основным объяснением нерастворимости BaSO4 в воде является его кристаллическая структура. BaSO4 образует кристаллы с ионной решеткой, которые являются очень устойчивыми. Каждый ион бария (Ba2+) окружен шестью ионами серы (S2-), а каждый ион серы окружен шестью ионами бария. Это является причиной низкой энергии срыва ионов из решетки, что делает BaSO4 практически нерастворимым в воде.
Кроме того, BaSO4 образует прочные связи водорода с водой, что усиливает его нерастворимость. Водородные связи образуются между атомами серы в BaSO4 и молекулами воды. Эти водородные связи являются дополнительными преградами для растворения BaSO4, так как они оказывают дополнительное влияние на стабильность кристаллической решетки.
Таким образом, химическая структура и кристаллическая решетка BaSO4 являются основной причиной его нерастворимости в воде. Это свойство непосредственно связано с высокой устойчивостью и сложной структурой соединения. Благодаря этому, BaSO4 находит широкое применение в различных областях, таких как медицина, промышленность и научные исследования.
Причины нерастворимости BaSO4 в воде

Первая причина нерастворимости BaSO4 в воде заключается в его решетке. Барийсульфат образует твердые кристаллы, в которых атомы бария (Ba) и атомы серы (S) располагаются в решетке с ионами кислорода (O). Эта решетка обладает высокой стабильностью и крепостью, что делает трудным разрушение и растворение соединения.
Другая причина нерастворимости BaSO4 связана с полярностью молекулы. Вода является полярным растворителем, так как ее молекула имеет положительные и отрицательные заряды. Барийсульфат, в свою очередь, является неполярным соединением, так как его кристаллическая структура не обладает зарядами. Поэтому нет притяжения между молекулами BaSO4 и молекулами воды, что препятствует растворению в воде.
Кроме того, образование слоя гидратации также уменьшает растворимость BaSO4 в воде. Когда молекулы BaSO4 взаимодействуют с молекулами воды, образуется слой гидратации вокруг частиц BaSO4. Этот слой предотвращает дальнейшее растворение соединения и обеспечивает нерастворимость BaSO4.
Итак, причины нерастворимости BaSO4 в воде связаны с его кристаллической структурой, неполярностью соединения и образованием слоя гидратации вокруг частиц BaSO4. Эти факторы в совокупности делают BaSO4 практически нерастворимым в воде.
Кристаллическая структура
Данная структура делает сильные электростатические силы между ионами вещества BaSO4. Атомы бария, которые имеют положительный электрический заряд, притягивают атомы серы с отрицательным зарядом и наоборот. Именно эти силы препятствуют растворению BaSO4 в воде.
Следует отметить, что BaSO4 имеет очень низкую растворимость в воде – около 2 мг/литр. Это связано с тем, что кристаллическая структура BaSO4 обладает высокой энергией решетки, что затрудняет разрушение связей между атомами при контакте с водой. Более того, BaSO4 не проявляет тенденцию к гидратации, то есть к образованию каких-либо сложных с водой соединений.
Таким образом, кристаллическая структура BaSO4 обеспечивает высокую стабильность этого соединения и делает его практически нерастворимым в воде.
Силы ионных связей
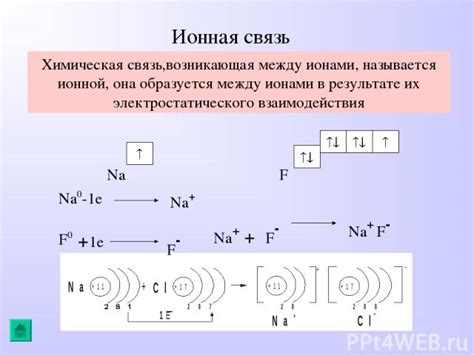
При изучении неспособности BaSO4 (бариевого сульфата) к растворению в воде необходимо обратить внимание на силы ионных связей, которые играют ключевую роль в стабильности этого соединения.
Бариевый сульфат содержит положительно заряженные ионы бария (Ba2+) и отрицательно заряженные ионы сульфата (SO42-). Эти ионы образуют ионную решетку, где катионы и анионы удерживаются вместе с помощью электростатических сил притяжения.
Ионные связи являются очень сильными и стабильными. Это означает, что электростатическая сила, удерживающая ионы в решетке, очень велика и не может быть легко разрушена простым растворением в воде. Когда BaSO4 попадает в воду, молекулы воды окружают ионы соединения, но их полярность и противоположные заряды не могут сделать связь между ионами бария и сульфата достаточно слабой для полного разрушения ионной решетки.
Таким образом, причиной нерастворимости BaSO4 в воде являются сильные ионные связи, которые образуют его структуру. Это также объясняет стабильность и инертность бариевого сульфата в обычных условиях окружающей среды.
Природа ионов

Барий (Ba2+) - это ион с положительным зарядом, который образуется при потере двух электронов атомом бария (Ba). Ион сульфата (SO42-) имеет отрицательный заряд и образуется при потере двух электронов атомом серы (S) и присоединении к нему четырех атомов кислорода (О).
Ионы бария и сульфата обладают высокой полярностью, что делает их очень трудно растворимыми в воде. При контакте с водой, молекулы воды, состоящие из одного атома кислорода и двух атомов водорода, образуют водородные связи между собой. Данная структура воды создает особые условия, при которых ионы бария и сульфата образуют сильные ионо-дипольные связи со молекулами воды.
В результате образуются ионо-водородные связи между ионами соли и молекулами воды. Такие связи гораздо сильнее, чем связи между ионами соли, что препятствует растворению BaSO4 в воде. Это объясняет низкую растворимость BaSO4 и его невозможность образовывать стабильный раствор в воде.
Вещества с похожей природой ионов также обладают низкой растворимостью в воде. Понимание природы ионов помогает объяснить множество физико-химических свойств веществ и их поведение в различных средах.
| Ионы | Заряд |
|---|---|
| Барий (Ba2+) | + |
| Сульфат (SO42-) | - |
Размеры ионообменных кластеров
При растворении твердого вещества в воде происходит процесс ионизации, в результате которого образуются ионы, окруженные водородными молекулами. Однако, в случае растворения BaSO4 (барийсульфата) в воде, процесс ионизации происходит очень медленно и неполно. Это связано с особыми свойствами молекул BaSO4 и ионообменных кластеров, которые образуются в процессе его растворения.
Барийсульфат представляет собой твердое вещество, образованное из ионов бария (Ba2+) и ионов сульфата (SO42-). Молекулы BaSO4 обладают очень малыми размерами, по сравнению с поверхностью их ионов. Это делает их слабо доступными для взаимодействия с водой и затрудняет процесс ионизации. Ионы бария (Ba2+) и ионы сульфата (SO42-) образуют кластеры, то есть группы связанных между собой молекул. Эти кластеры имеют большие размеры и не могут полностью взаимодействовать с водой.
| Тип кластера | Описание |
|---|---|
| Барийный кластер | Образуется благодаря взаимодействию ионов бария между собой. |
| Сульфатный кластер | Образуется благодаря взаимодействию ионов сульфата между собой. |
Ионообменные кластеры находятся в состоянии равновесия с нерастворенным BaSO4. Вода проникает только в поверхностные слои этих кластеров и образует слабые водородные связи. Такое взаимодействие недостаточно сильно, чтобы разрушить ионообменные кластеры и полностью растворить BaSO4.
Таким образом, размеры ионообменных кластеров и их слабая взаимодействие с водой являются основными причинами нерастворимости BaSO4 в воде. Эти свойства объясняют, почему барийсульфат используется в медицинской диагностике, например, при рентгенологических исследованиях, где необходимо создать контраст для визуализации определенных областей организма.
Силы гидратации ионообменных кластеров
Барийсульфат является сильно растворимым в воде ионным соединением, поэтому его растворение в воде происходит постепенно и незаметно для глаза. При взаимодействии молекулы бария (Ba2+) с молекулами воды происходит образование гидратных ионов, которые затем окружаются слоями воды. Такие ионообменные кластеры окружены молекулами воды настолько тесно, что достаточно сильно связаны между собой.
Сильные силы гидратации препятствуют разрушению ионообменных кластеров и, следовательно, растворению барийсульфата в воде. Молекулы воды не могут связаться с сульфатными и бариевыми ионами настолько тесно, чтобы эффективно разрушить ионообменные кластеры и вывести барийсульфат в раствор. В результате, барийсульфат остается в виде нерастворимого осадка, который оседает на дне сосуда.
| Соединение | Растворимость в воде |
|---|---|
| Барийсульфат (BaSO4) | 0.000244 г/100 мл воды |
| Хлорид натрия (NaCl) | 359 г/100 мл воды |
| Нитрат калия (KNO3) | 316 г/100 мл воды |
Реакции с водой

При попытке растворить BaSO4 добавлением в воду, наблюдается формирование нескольких неизменных физических процессов. Барийсульфат BaSO4 не растворяется в воде, так как в молекуле BaSO4 включено ковалентное связывание, что делает его инертным в отношении воды.
Когда BaSO4 взаимодействует с водой, происходит образование ионов бария (Ba2+) и сульфата (SO42-). Данная реакция описывается химическим уравнением:
BaSO4 + H2O → Ba2+ + SO42-
Таким образом, BaSO4 образует нерастворимый соединение в воде, ионизируясь в отдельные ионы. Образование нерастворимого осадка при взаимодействии с водой объясняется высокой энергией решетки кристаллов BaSO4 и слабостью сил водородной связи воды в отношении этой решетки.
Появление этого нерастворимого соединения наблюдается при растворении других сульфатов бария в воде. Из-за этой нерастворимости BaSO4 имеет широкую область применения, включая использование в медицине и внутренних органических и неорганических химических анализах.