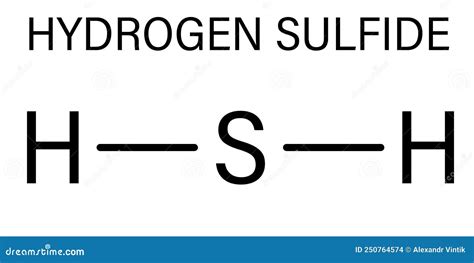
Сульфид водорода (H2S) - молекула, состоящая из двух атомов водорода и одного атома серы. В силу своей структуры, H2S имеет способность к различным реакциям, но не распадается на ионы в растворе. Почему же это происходит?
Ответ заключается в том, что H2S является слабой кислотой. Это означает, что в водных растворах H2S осуществляет диссоциацию, образуя ионы гидрогена (H+) и ионы гидросульфида (HS-). Однако, в отличие от сильных кислот, таких как серная кислота (H2SO4), H2S не диссоциирует полностью, и только небольшая часть H2S молекул распадается на ионы.
Существует несколько причин, по которым H2S не распадается полностью на ионы. Во-первых, это связано с электрохимическим потенциалом H2S молекул, который является ниже, чем электродный потенциал водородного ионa. Это обозначает, что H2S молекулы имеют склонность к получению электронов и формированию молекул, а не ионов.
Молекулярная структура H2S
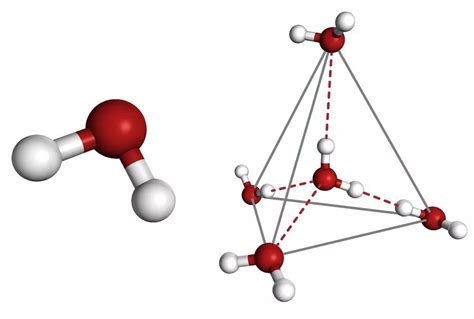
Молекулярная структура H2S выглядит как V-образная форма, где два атома водорода расположены на концах V-образной конфигурации, а атом серы находится в середине. Данная форма связана с наличием электронных пар на атомах серы и водорода, которые отталкиваются друг от друга, придавая молекуле эту угловую структуру.
Такая конфигурация молекулы H2S обусловлена тремя общими электронными парами внешней оболочки серы и одной общей электронной парой внешней оболочки водорода, вследствие этого, электронные облака смещаются, атому серы в центре области и атомам водорода по края электронное облако.
Свойства H2S

Хотя сероводород является кислотным газом, он не диссоциирует на ионы в водном растворе, поскольку это незначительное количество газа растворяется в воде. Слабая кислотность H2S объясняется диссоциацией только некоторой части H2S молекул на гидрогидрсульфидные и сульфидные ионы:
2H2S ⇌ HS⁻ + H⁺ ⇌ S²⁻ + 2H⁺
Сероводород обладает характерным запахом гниющих яиц, и это является одним из его основных свойств. Он также является токсичным газом, поэтому его вдыхание может вызвать серьезные проблемы со здоровьем. Он образуется при разложении органического материала в отсутствии кислорода, поэтому его запах часто ассоциируется с гнилостной деятельностью.
H2S также хорошо растворяется в воде и образует слабокислые растворы. Это свойство делает его полезным в некоторых химических реакциях и процессах, включая гидросульфидные воды.
Кинетическая инертность H2S
Процесс распада молекулярного соединения на ионы обычно связан с протеканием химической реакции. Однако, в случае H2S, распад на ионы происходит с низкой скоростью или не происходит вообще. Это связано с особенностями строения молекулы водородсульфида.
Молекула H2S имеет ковалентную связь между атомами серы и водорода, что делает ее стабильной. Сильная связь между атомами предотвращает их распад и образование ионов. Кроме того, эта связь обладает высокими энергетическими барьерами, необходимыми для разрыва химических связей.
Также следует отметить, что водородсульфид практически не ионизируется в водных растворах или в других полярных растворителях. Это связано с низкой полярностью молекулы H2S, что препятствует образованию ионов.
В связи с этим, H2S обычно рассматривается как слабый электролит. Кинетическая инертность H2S имеет важные практические применения, так как позволяет использовать его в различных технологических процессах, включая нефтегазовую промышленность и производство химических веществ.
Электронная конфигурация H2S

Молекула H2S состоит из атомов водорода (H) и серы (S), каждый из которых имеет свою электронную конфигурацию.
Атом серы (S) имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^2 3p^4. Это означает, что внешний электронный слой атома серы содержит 6 электронов, и он находится во втором периоде и шестой группе таблицы элементов Менделеева. Валентная оболочка атома серы содержит 6 электронов - два в 3s-орбитали и четыре в 3p-орбитали.
Атом водорода (H) имеет электронную конфигурацию 1s^1. Это означает, что внешний электронный слой атома водорода содержит один электрон, и он находится в первом периоде и первой группе таблицы элементов Менделеева.
Когда молекула H2S образуется, каждый атом водорода обменивает свой одиночный электрон с одним из электронов в валентной оболочке атома серы. В результате образуется двойная ковалентная связь между серой и каждым атомом водорода, и общая электронная конфигурация молекулы H2S становится 1s^2 2s^2 2p^6 3s^2 3p^4, что соответствует электронной конфигурации атома серы.
Электронная конфигурация молекулы H2S позволяет ей сохранять свою стабильность и не распадаться на ионы.
H2S и электрическое взаимодействие
Молекула H2S состоит из двух атомов водорода и одного атома серы, которые связаны ковалентной связью. Ковалентная связь предполагает совместное использование электронов атомами вещества.
Из-за высокой электроотрицательности серы и водорода, атомы водорода приобретают положительный заряд, а атом серы – отрицательный заряд. Электрическое взаимодействие между заряженными атомами наблюдается внутри молекулы H2S.
Однако, при контакте с водой, молекула H2S распадается на ионы. Вода обладает способностью ионизироваться и образовывать ионы. Поступая в раствор, молекула H2S реагирует с водой и распадается на ионы H+ и HS-. Ионы H+ образуются путем отщепления одного атома серы, а ионы HS- получаются путем присоединения атома водорода из воды.
Распад молекулы H2S на ионы обусловлен реакцией с водой и является химическим процессом.
Низкая энергия расщепления H2S

Основной фактор, определяющий низкую энергию расщепления H2S, является сильная связь между атомами серы и водорода. Водородные связи, образуемые между атомами водорода и атомами серы, имеют высокую энергию связи, что делает их стабильными.
Кроме того, энергия расщепления H2S также зависит от окружающей среды. В присутствии воды, H2S может ассоциироваться с молекулами воды, образуя гидраты, что еще более затрудняет его расщепление на ионы.
| Молекула | Энергия связи (кДж/моль) |
|---|---|
| H2 | 436 |
| H2S | 335 |
| H2O | 464 |
Из приведенных выше данных видно, что энергия связи в молекуле H2S значительно ниже, чем в молекулах H2 и H2O. Это означает, что молекула H2S имеет более слабые связи, что делает ее более стабильной и мало склонной к расщеплению на ионы.
Таким образом, низкая энергия расщепления H2S обусловлена сильной водородной связью между атомами серы и водорода, а также возможностью образования гидратов H2S в присутствии воды.