Другой химический элемент, способный прекрасно растворяться в воде, - это натрий. Натрий является щелочным металлом с атомным номером 11 и химическим символом Na на периодической таблице элементов. В своем элементарном состоянии натрий очень реакционен и реагирует с водой, образуя натриевую гидроксидныхидроген. Однако, когда натрий сочетается с другими элементами, такими как азот и кислород, образуется многочисленная группа химических соединений, которая включает в себя вещества под общим названием нитраты.
Одним из таких соединений является нитрат натрия, известный как NaNO3 или nano3. Нитрат натрия - это белый кристаллический порошок, который хорошо растворяется в воде. Почему это происходит?
На самом деле, причина того, что nano3 хорошо растворяется в воде, имеет отношение к взаимодействию между натриевыми и нитратными ионами. Вода, как мы все знаем, является полярным растворителем, что означает, что молекулы воды имеют некоторое неравномерное распределение электрических зарядов. Полярность воды создает положительный заряд на одном конце молекулы и отрицательный заряд на другом конце.
Исследование растворимости nano3
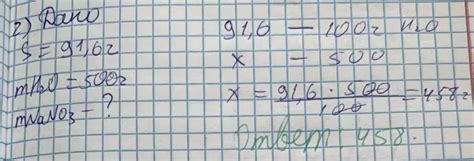
В случае нитрата натрия (NaNO3) также проводятся исследования его растворимости. Данный соединение хорошо растворяется в воде, и это свойство имеет свои особенности и причины.
Первая причина - ионный характер соединения. Нитрат натрия (NaNO3) содержит ионы натрия (Na+) и нитратные ионы (NO3-). Ионы вещества обладают электрическим зарядом и способны образовывать электростатические связи с другими ионами или молекулами растворителя.
Вторая причина - полярность молекулы воды. Вода (H2O) является полярным соединением, что означает, что у нее есть положительный и отрицательный полюса. Водные молекулы образуют с веществом водородные связи и облучают его положительными и отрицательными зарядами, что способствует разрушению ионо-ионных связей молекул вещества.
Таким образом, комбинация ионного характера соединения и полярности молекулы воды обеспечивает хорошую растворимость нитрата натрия (NaNO3) в воде. Это свойство делает его широко используемым соединением в химической и фармацевтической промышленности, а также в других научных и технических областях.
Уникальные свойства соединения

Молекула nano3 обладает рядом уникальных свойств, которые обуславливают его высокую растворимость в воде.
Во-первых, nano3 является солью, которая содержит ионы натрия и нитрата. Они обладают высокой полярностью и взаимодействуют с молекулами воды посредством водородных связей. Это позволяет nano3 эффективно растворяться в воде и разбиваться на ионы.
Во-вторых, молекула nano3 обладает высокой химической стабильностью. Она не подвержена диссоциации или разложению в воде, что способствует его полному растворению. Это позволяет nano3 быть хорошим растворителем для других веществ, так как оно не взаимодействует с ними химически.
Кроме того, растворение nano3 в воде сопровождается выделением тепла. Это явление называется экзотермической реакцией и является причиной повышения температуры при растворении nano3 в воде. Энергия, выделяющаяся при растворении, способствует разрушению водородных связей между молекулами воды и улучшает процесс растворения nano3.
В результате, nano3 обладает способностью эффективно растворяться в воде и разбиваться на ионы без изменения своей структуры. Это делает его важным соединением для различных применений, включая промышленность, медицину и научные исследования.
Эффекты протонации и дефектов кристаллической структуры
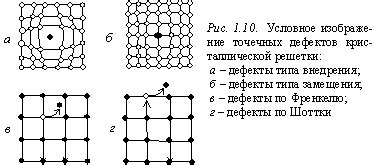
Растворимость nano3 в воде обусловлена эффектами протонации и дефектов кристаллической структуры. Протонация, или передача протона, играет важную роль в растворении солей и взаимодействии с водными молекулами.
Вода может протонировать ион НО3-, образуя гидроксидные и нитрозные кислоты, что способствует растворению nano3. Протонация помогает увеличить растворимость соли, так как эти продукты реакции легко растворимы в воде.
Однако, помимо протонации, дефекты кристаллической структуры также влияют на растворимость nano3. Дефекты могут создавать промежутки или пустоты в кристаллической решетке, позволяя водным молекулам проникать внутрь структуры и взаимодействовать с ионами.
Наличие дефектов увеличивает поверхностную активность и способствует быстрому распаду раствора, что способствует более эффективному растворению nano3. Дефекты кристаллической структуры также влияют на динамику процесса растворения и могут изменять скорость и равновесие этого процесса.
Растворимость nano3 в воде зависит от различных факторов, таких как температура, давление и концентрация иона. Однако, эффекты протонации и дефектов кристаллической структуры являются основными факторами, которые обеспечивают хорошую растворимость nano3 в воде.
Механизм растворения nano3
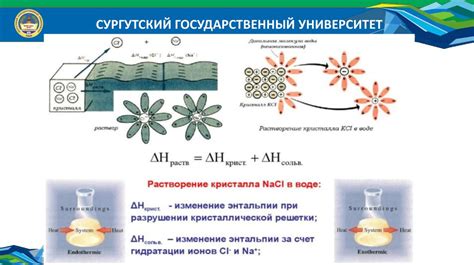
Когда кристаллы NaNO3 попадают в воду, они распадаются на ионы натрия (Na+) и нитрат-ионы (NO3-). Эта реакция отражается следующим уравнением:
NaNO3 → Na+ + NO3-
Ионы Na+ и NO3- обладают полярными свойствами и способны взаимодействовать с молекулами воды. Вода, как полярный растворитель, образует вокруг ионов На+ и NO3- оболочку с взаимными электростатическими притяжениями.
Взаимодействие между ионами Na+ и водными молекулами приводит к образованию гидратированных ионов Na+·nH2O. Эти гидратированные ионы легко перемещаются в растворе, обеспечивая его проводимость. Аналогично, нитрат-ионы (NO3-) также гидратируются и свободно перемещаются в воде.
Таким образом, благодаря образованию гидратированных ионов Na+·nH2O и NO3- вода эффективно растворяет нитрат натрия. Этот процесс не требует значительной энергии и осуществляется быстро и эффективно.
Роль межмолекулярных сил
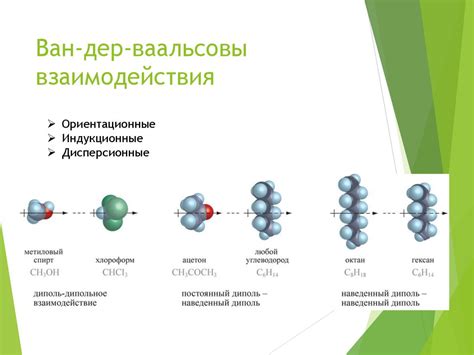
Взаимодействие между молекулами вещества играет важную роль в процессе растворения nano3 в воде. При растворении вода вступает во взаимодействие с ионами натрия и нитрата, создавая межмолекулярные связи.
Межмолекулярные силы включают в себя два основных типа взаимодействий: ван-дер-ваальсово ион-дипольное взаимодействие и водородные связи.
Водородные связи играют особенно важную роль в растворении nano3 в воде. Вода обладает полярной структурой благодаря наличию электронно-донорных групп (кислородных атомов) и электроакцепторных групп (водородных атомов). Кислородные атомы воды образуют водородные связи со свободными электронными парами электроакцепторных групп, что способствует стабилизации растворенных ионов nano3.
Кроме того, водородные связи между водой и ионами nano3 обеспечивают высокую плотность растворения. Ионы nano3 образуют гидратные оболочки, при этом окружающие молекулы воды образуют сеть водородных связей, которая значительно увеличивает растворимость вещества.
Таким образом, межмолекулярные силы, включая водородные связи и ван-дер-ваальсовы взаимодействия, играют важную роль в растворении nano3 в воде. Эти силы позволяют образовывать стабильные гидратные оболочки вокруг ионов, обеспечивая высокую растворимость вещества в данной среде.
Практическое применение растворимости Nano3

Растворимость NaNO3 в воде имеет широкое практическое применение в различных отраслях. Натриевый нитрат обладает рядом полезных свойств, которые делают его важным компонентом в производстве различных продуктов и процессах.
Одним из основных применений NaNO3 является его использование в сельском хозяйстве как удобрение. Натриевый нитрат содержит азот, который является необходимым элементом для роста растений. При добавлении NaNO3 к почве, удобрение обогащает ее азотом, что способствует увеличению урожайности и повышению качества выращиваемых культур.
Кроме того, NaNO3 используется в производстве взрывчатых веществ, таких как динамит. Являясь окислителем, натриевый нитрат повышает эффективность взрыва и увеличивает его силу. Это свойство делает NaNO3 важным компонентом для военной и промышленной отрасли.
Уникальные свойства растворимости NaNO3 также применяются в процессе охлаждения. Раствор NaNO3 в воде имеет отличные холодильные свойства. При перемешивании воды с NaNO3 и последующем охлаждении получается холодный раствор, который используется в системах кондиционирования воздуха и промышленных холодильных системах. Это позволяет снизить энергопотребление и обеспечить эффективное охлаждение.