Соль - один из самых распространенных и важных минеральных соединений. Она широко используется в пищевой и химической промышленности, а также в медицине и научных исследованиях. Однако, есть одно любопытное свойство соли, которое вызывает вопросы: почему она не растворяется в спирте?
Спирт - органическое соединение, которое обычно получают путем ферментации или дистилляции алкогольных напитков. Он широко применяется в множестве сфер, включая медицину, химию и производство. Но при попытке растворить соль в спирте, мы сталкиваемся с проблемой: соль просто не растворяется. Это явление можно объяснить несколькими причинами.
Во-первых, соль обладает полярной структурой, что означает, что ее молекулы имеют заряженные части. Эта полярность делает соль растворимой в других полярных растворителях, таких как вода. Однако, спирт является не полярным растворителем, что делает его несовместимым с солью. Фактически, спирт не обладает достаточной полярностью, чтобы преодолеть притяжение между ионами в соли и растворить ее.
Причины и объяснение нерастворимости соли в спирте

Соль, как химическое соединение, обычно хорошо растворяется в воде, но плохо растворяется в спирте. Это связано с различиями в молекулярной структуре воды и спирта, а также их химическими свойствами.
Главная причина нерастворимости соли в спирте заключается в том, что спирт не образует водородные связи с солью, как это делает вода. Водородные связи являются сильными межмолекулярными силами, которые способствуют растворению соли в воде. Спирт, с другой стороны, образует слабые дисперсные взаимодействия с солью, что делает процесс растворения менее эффективным.
Кроме того, спирт обладает низкой полярностью, что также затрудняет растворение соли. Вода, в отличие от спирта, является сильным полярным растворителем, что способствует образованию гидратных оболочек вокруг ионов соли и их последующему разделению.
Из-за этих факторов, соль не растворяется полностью в спирте и остается в виде нерастворимых осадков. Однако, некоторые соли могут растворяться в спирте до некоторой степени, особенно если они обладают высокой растворимостью в неполярных растворителях.
Таким образом, нерастворимость соли в спирте обусловлена как химическими свойствами спирта, так и его молекулярной структурой. Это явление имеет практическое значение, так как спирт часто используется в химической лаборатории и в других областях, и его способность растворять или не растворять соли может быть важным фактором при проведении различных экспериментов и процессов.
Строение молекул соли и спирта
Чтобы понять, почему соль не растворяется в спирте, необходимо рассмотреть строение молекул соли и спирта.
Молекула соли, такой как хлористый натрий (NaCl), состоит из двух ионов - положительного натриевого иона (Na+) и отрицательного хлоридного иона (Cl-). Эти ионы образуют кристаллическую решетку, в которой ионы расположены в периодическом порядке.
Спирты, например, этанол (C2H5OH), также образуют молекулярные соединения. Они состоят из углеродного каркаса, к которому прикреплены гидроксильные группы (-OH). Молекулы спирта держатся вместе через слабые межмолекулярные силы водородной связи.
| Молекула соли | Молекула спирта |
|---|---|
| Na+ Cl- | C2H5OH |
| Ионная решетка | Молекулярные соединения |
Строение молекул соли и спирта имеет различие в типе связей и организации частиц. Молекулы соли жестко удерживаются в ионной решетке, а молекулы спирта слабо связаны между собой.
Когда соль попадает в спирт, межмолекулярные силы водородной связи между молекулами спирта оказываются сильнее, чем ионные связи между ионами соли. Следовательно, ионы соли не могут вытеснить молекулы спирта из их ассоциации, что препятствует растворению соли в спирте.
Таким образом, строение молекул соли и спирта играет решающую роль в их взаимодействии и определяет нерастворимость соли в спирте.
Полярность молекул и взаимодействие
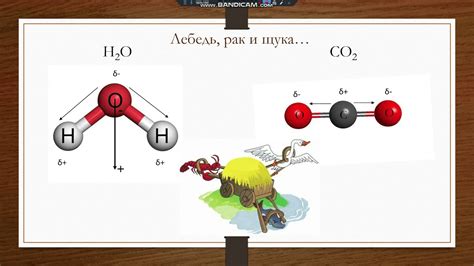
Полярные молекулы имеют неравномерное распределение зарядов: одна часть молекулы имеет положительный заряд, а другая - отрицательный. Примерами полярных молекул являются молекулы воды (H2O) и аммиака (NH3). Вода, например, имеет положительный заряд водородных атомов и отрицательный заряд кислородного атома.
Неполярные молекулы, наоборот, имеют равномерное распределение зарядов внутри молекулы и не образуют диполь. Такие молекулы обычно состоят из атомов с одинаковой электроотрицательностью или атомов, взаимодействующих через симметричные связи. Примерами неполярных молекул являются молекулы кислорода (O2) и азота (N2).
Взаимодействие между молекулами вещества определяется их полярностью. Полярные молекулы могут взаимодействовать между собой через притяжение положительных и отрицательных зарядов. Это взаимодействие позволяет полярным веществам образовывать растворы в других полярных растворителях, таких как вода.
Однако, спирт (этиловый спирт, CH3CH2OH) является полярным растворителем, но не может растворить соль. Это объясняется тем, что спирт не обладает достаточной полярностью для взаимодействия с ионами соли. Соль (NaCl), например, состоит из позитивно заряженного иона натрия (Na+) и негативно заряженного иона хлорида (Cl-). Вода, которая является более полярным растворителем, может эффективно разделить эти ионы, образуя гидратированный оболочку вокруг них, что позволяет растворению соли в воде.
Таким образом, недостаточная полярность спирта препятствует его способности взаимодействовать с ионами соли, что делает невозможным растворение соли в спирте.
Разность полярностей молекул соли и спирта
Причина, по которой соль не растворяется в спирте, связана с разностью полярностей между молекулами соли и спирта.
Соль представляет собой ионное соединение, состоящее из положительно и отрицательно заряженных ионов. За счет электрического притяжения между ионами, молекулы соли образуют кристаллическую решетку, которая при растворении разрушается.
Спирт, с другой стороны, является ковалентным соединением, где электроны общих связей делятся между атомами. В связи с этим молекулы спирта имеют нетипичное электромагнитное поле и являются менее полярными, чем молекулы соли.
Именно эта разность полярностей между молекулами соли и спирта препятствует их взаимодействию и растворению. Молекулы спирта не способны притягивать и удерживать ионы соли, что делает растворение соли в спирте невозможным или очень медленным.
Таким образом, различие в полярности между молекулами соли и спирта является основной причиной нерастворимости соли в спирте.
Способность молекул соли образовывать решетку
Однако, спирт, в отличие от воды, не обладает такой же способностью разбивать молекулы соли на ионы. Молекулы спирта не взаимодействуют с молекулами соли таким же образом, как молекулы воды, что делает их менее способными образовывать раствор.
Более того, молекулы спирта имеют гидрофобные свойства, то есть они не притягивают воду. В результате, молекулы спирта предпочитают взаимодействовать друг с другом, формируя свою собственную решетку.
Таким образом, из-за способности молекул соли образовывать решетку и отсутствия способности спирта разбивать эту решетку, соль не растворяется в спирте. Это объясняет физическое явление нерастворимости соли в спирте и позволяет понять, почему соль растворяется лучше в воде.
Гидратация молекул соли в воде

Когда молекулы соли попадают в воду, они могут стать гидратированными, то есть окружиться слоем молекул воды. Гидратация происходит благодаря силе притяжения между полярными молекулами соли и молекулами воды.
Одна из причин, почему соль не растворяется в спирте, заключается в том, что молекулы спирта не обладают полярностью в такой степени, как молекулы воды. Поэтому они не способны образовывать с молекулами соли достаточно сильные взаимодействия, чтобы гидратировать их. В результате, молекулы соли остаются не гидратированными и не растворяются в спирте.
Следует отметить, что существуют определенные ионы или соли, которые могут растворяться в спирте. Однако, это связано с особыми свойствами этих соединений, которые обеспечивают сильную полярность ионообразующихся частиц.
В случае с водой, ее молекулы формируют гидратационную оболочку вокруг ионов соли, притягивая их благодаря сильным полярным связям. Именно эта гидратация позволяет молекулам соли разделиться на ионы и распространиться по всему объему воды.
Таким образом, невозможность гидратации молекул соли в спирте является основной причиной, почему соль не растворяется в данном растворителе.
Растворимость других веществ в спирте
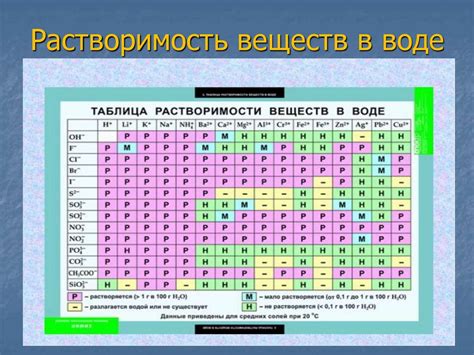
Вода, неорганический растворитель, обычно плохо растворяется в спирте, и наоборот. Однако, есть некоторые вещества, которые могут растворяться как в воде, так и в спирте. Это связано с их органической структурой, поларностью и силой взаимодействия между молекулами.
Например, многие сахара, включая глюкозу и фруктозу, хорошо растворяются и в воде, и в спирте. Это связано с тем, что они имеют гидроксильные группы, которые могут образовывать водородные связи с молекулами воды, а также образуют дополнительные взаимодействия с молекулами спирта.
Некоторые кислоты и щелочи также растворимы в спирте, хотя не так хорошо, как в воде. Это связано с их способностью образовывать ионы, которые могут взаимодействовать с поларами растворителями, такими как спирт.
Кроме того, многие органические растворители, такие как ацетон, диэтиловый эфир и бензол, также хорошо растворяются в спирте. Это связано с тем, что они имеют схожую структуру и полярность, что способствует образованию взаимных растворов.
| Вещество | Растворимость в спирте |
|---|---|
| Глюкоза | Хорошо растворима |
| Фруктоза | Хорошо растворима |
| Этанол | Полностью растворим |
| Ацетон | Хорошо растворим |
| Диэтиловый эфир | Хорошо растворим |
| Бензол | Хорошо растворим |
Таким образом, растворимость различных веществ в спирте может быть объяснена на основе их структуры, полярности и способности к образованию взаимодействий с молекулами спирта.
Практическое применение нерастворимости соли в спирте
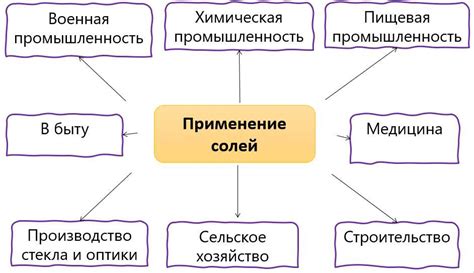
Нерастворимость соли в спирте обладает рядом практических применений, которые находят свое применение в разных областях науки и технологий.
| Область | Применение |
|---|---|
| Химия | Нерастворимость соли в спирте используется при проведении химических реакций, где требуется исключить влияние спирта на продукты реакции. Также это свойство может применяться для отделения и очистки смесей солей и спирта. |
| Фармацевтика | В фармацевтической промышленности нерастворимость соли в спирте используется для выделения и очистки активных веществ, а также в процессе хранения и транспортировки лекарственных препаратов, чтобы сохранить их стабильность и эффективность. |
| Аналитическая химия | Нерастворимость соли в спирте может использоваться в аналитических методах для селективного выделения определенных ионов или соединений, что позволяет провести точную и качественную анализ пробы. |
| Пищевая промышленность | В производстве напитков и спиртных напитков нерастворимость солей в спирте играет важную роль при очистке и фильтрации продукта. Она позволяет удалить нежелательные примеси веществ и получить высококачественный товар. |
| Научные исследования | Нерастворимость соли в спирте может использоваться в ходе научных исследований, где требуется изолировать или отделить определенные компоненты смеси для дальнейшего анализа или экспериментов. |
Таким образом, нерастворимость соли в спирте имеет широкое применение в различных областях и приносит значительную пользу в проведении различных процессов и технологий.