Термодинамика – это фундаментальная наука, занимающаяся изучением свойств тепла, работы и энергии. Она является одной из самых важных и широко применяемых наук в современном мире. Но почему именно термодинамика считается феноменологической теорией?
Одной из главных особенностей термодинамики является ее феноменологический характер. В отличие от многих других естественных наук, термодинамика не строит свою теорию на основе фундаментальных законов и принципов, а исходит из наблюдаемых явлений и экспериментальных данных. Это позволяет термодинамике быть универсальной и применимой к различным системам и процессам.
Феноменологический подход в термодинамике связан с изучением макроскопических свойств вещества и энергии. Основные понятия термодинамики, такие как температура, давление, энтропия, вводятся на основе опытных наблюдений и определенным образом связываются между собой. Таким образом, термодинамика не стремится к построению микроскопической картины происходящих процессов, а сосредотачивается на описании их глобальных закономерностей и свойств.
Феноменологическая теория тепла позволяет создавать модели и прогнозировать поведение систем при изменении условий. Это делает термодинамику не только мощным инструментом для анализа физических процессов, но и научной основой для разработки эффективных технологий и устройств. Поэтому термодинамика занимает важное место в науке и промышленности, обеспечивая многочисленные практические применения и возможности для совершенствования технического прогресса.
Термодинамика: история и сущность

Изначально, люди замечали, что тепло может передаваться от одного объекта к другому, что огонь может согревать, а холод - охлаждать. Однако, теоретическое объяснение процессов теплообмена и энергетических преобразований пришло намного позже.
Развитию термодинамики предшествовала долгая история открытий и исследований в области тепловой физики. Одним из первых великих открытий был эксперимент Жюля Жуля в 1843 году, который позволил установить механическую эквивалентность тепла и работы. Это открытие стало отправной точкой для присоединения теплоты к таким физическим величинам, как масса, длина и время.
Однако, понятие энергии и ее взаимодействия с материей продолжало развиваться. Исследованиям в области термодинамики обязаны такие концепции, как энтропия, энергия Гиббса и Гельмгольца, рабочие вещества и термодинамические процессы.
Суть термодинамической теории заключается в том, что она рассматривает системы в равновесии и изучает их свойства и превращения с помощью установленного набора законов и принципов. Термодинамические законы относятся к конкретным явлениям, природе материи и энергии, обеспечивая основу для создания новых машин и технологий.
Термодинамика является феноменологической теорией, так как она основывается на описании наблюдаемых явлений и экспериментальных данных без введения детальных молекулярных или атомных моделей. Такой подход позволяет использовать термодинамику в широком спектре приложений и обобщать ее законы на различные системы.
Феноменологическая теория тепла

Термодинамика рассматривает тепловые явления как феномены, объясняя их с помощью количественных закономерностей. Таким образом, термодинамика является феноменологической теорией тепла, то есть теорией, основанной на опыте и наблюдении явлений.
Главная цель термодинамики - изучение свойств и превращений тепловой энергии. Термодинамические законы обусловлены явлениями, которые наблюдаются в природе и в технике, и они не требуют построения объяснительной модели или микроскопического описания происходящих процессов. Таким образом, термодинамика сосредоточена на изучении макроскопических величин, являясь феноменологической в своей природе.
Феноменологическая природа термодинамики связана с тем, что она изучает лишь наблюдаемые явления и не вдается в подробности внутреннего строения вещества. Термодинамика оперирует с понятиями, такими как температура, давление, объем и энергия, без того чтобы подробно анализировать, как они связаны с атомами и молекулами.
Итак, термодинамика является феноменологической теорией тепла, изучающей наблюдаемые процессы и свойства тепловой энергии, без привязки к внутреннему строению материи. Эта наука не только ставит перед собой задачи изучения законов теплового равновесия и превращений энергии, но и находит широкое применение в инженерии, физике, химии и других областях науки и техники.
Основные принципы термодинамики

Первый закон термодинамики утверждает, что энергия не может быть создана или уничтожена, она может только преобразовываться из одной формы в другую. Это означает, что изменение внутренней энергии системы равно сумме работы, выполненной над системой, и теплоты, полученной или отданной системой.
Второй закон термодинамики включает несколько концепций, одной из которых является понятие энтропии. Энтропия - это мера беспорядка или неупорядоченности системы. Второй закон утверждает, что в изолированной системе энтропия всегда увеличивается или остается постоянной. То есть, процессы, происходящие в системе, всегда приводят к увеличению хаоса.
Существуют также две формулировки второго закона термодинамики: формулировка Клаузиуса и формулировка Кельвина-Планка. Формулировка Клаузиуса утверждает, что невозможно построить термодинамический процесс, в результате которого тепло полностью переходит от холодного тела к горячему без внешнего вмешательства. Формулировка Кельвина-Планка утверждает, что невозможно построить устройство, которое работает в одном цикле, преобразуя полностью полученное тепло в полезную работу без отброса некоторого количества тепла в окружающую среду.
Третий принцип термодинамики говорит о невозможности достижения абсолютного нуля температуры. Абсолютный ноль равен 0 К или -273,15 °C и является нижней границей возможных температур. По третьему принципу, чем ближе система подходит к абсолютному нулю, тем больше требуется энергии, чтобы продолжить охлаждение.
Термодинамика является феноменологической теорией тепла, так как она описывает явления и закономерности, наблюдаемые в реальных системах. Основные принципы термодинамики позволяют объяснить и предсказать результаты тепловых процессов, что делает ее незаменимой для многих областей науки и техники.
Термодинамические системы и процессы
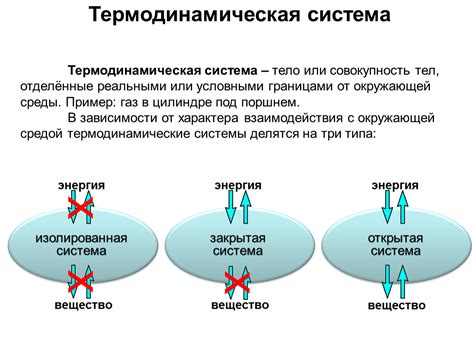
Термодинамические системы классифицируются по типу взаимодействия с окружающей средой. Закрытая система не обменивается ни веществом, ни энергией с окружающей средой. Открытая система взаимодействует с окружающей средой через обмен веществом и энергией. Изолированная система не взаимодействует ни с какими внешними системами. Также термодинамические системы могут быть гомогенными, если их свойства одинаковы в каждой точке системы, или же гетерогенными, если свойства внутри системы различаются.
В термодинамике выделяют несколько основных типов процессов, которые могут происходить в термодинамических системах. Адиабатический процесс - процесс, в котором нет теплообмена между системой и окружающей средой. Изохорный (изовольуметрический) процесс - процесс, при котором объем системы постоянен. Изотермический процесс - процесс, при котором температура системы остается неизменной. Изобарный процесс - процесс, при котором давление системы остается постоянным.
Термодинамика изучает энергетические состояния системы и их изменение во время процессов. Основными величинами, описывающими термодинамическую систему, являются внутренняя энергия, объем, давление и температура. Между ними существуют различные уравнения состояния, которые позволяют связать эти величины и описывают поведение системы в различных условиях.
Термодинамика является феноменологической теорией тепла, так как она описывает явления, связанные с тепловыми процессами, исходя из наблюдаемых эффектов и ограничений, а не из основных молекулярных взаимодействий. В то же время термодинамические законы и уравнения широко применяются в технике и науке для расчета и исследования различных физических систем и процессов.
Первый закон термодинамики: сохранение энергии

Согласно первому закону термодинамики, энергия может быть преобразована из одной формы в другую, но ее общая сумма остается постоянной в изолированной системе. Это означает, что энергия, потраченная на работу или выделившаяся в виде тепла, не может быть восстановлена до своего исходного состояния.
Первый закон термодинамики может быть выражен следующим образом:
Внутренняя энергия системы равна сумме работы, совершенной над системой, и теплоты, переданной ей:
∆U = W + Q
Где ∆U представляет изменение внутренней энергии системы, W представляет работу, совершенную над системой, а Q представляет теплоту, переданную системе.
Первый закон термодинамики демонстрирует, что энергия является консервативной величиной и не может быть создана или уничтожена. Этот закон играет важную роль в понимании принципов работы различных тепловых и энергетических систем, а также в развитии новых технологий для эффективного использования и преобразования энергии.
Второй закон термодинамики: энтропия и необратимость
Этот закон тесно связан с понятием энтропии, которая является величиной, характеризующей упорядоченность или беспорядочность системы. Чем выше энтропия, тем более беспорядочная система. Согласно второму закону термодинамики, энтропия изолированной системы всегда будет увеличиваться или оставаться постоянной, но никогда не уменьшаться.
Существует множество способов объяснить второй закон термодинамики и связанные с ним процессы необратимости в физике. Один из них – концепция Больцмана, который связал энтропию с вероятностью макроскопических состояний системы. Он показал, что количество макроскопических состояний, соответствующих беспорядочному состоянию, намного больше, чем состояний, соответствующих упорядоченному состоянию. Поэтому вероятность перехода системы от упорядоченного состояния к беспорядочному (увеличение энтропии) больше, чем вероятность обратного процесса.
Второй закон термодинамики имеет широкое применение в различных областях, от космологии до инженерии. Он объясняет, почему тепло не может самоизолироваться и перетекать только от холодного тела к горячему, а также ограничивает эффективность работы термодвигателей. Этот закон имеет фундаментальное значение и переворачивает наше представление о времени и возможности восстановления упорядоченных состояний.