Марганец – элемент, который является важным составным элементом в различных отраслях промышленности и биологии. Величина его валентности, то есть способность образовывать соединения с другими элементами, может значительно варьировать в зависимости от условий.
Марганец в основном имеет валентность 2+. Это означает, что он может потерять два электрона и образовать ион Mn2+, который обладает положительным зарядом. В таком состоянии марганец образует много соединений, которые широко используются в промышленности и сельском хозяйстве.
Тем не менее, марганец также может иметь валентность 3+. В этом состоянии он образует ион Mn3+, который обладает еще большей силой окисления и восстановления. Такое свойство марганца делает его полезным в процессах окисления и восстановления, таких как каталитические реакции и электрохимические процессы.
Но почему марганец не имеет валентности 5+? В валентности 5+ марганец образовал бы ион Mn5+, который был бы положительно заряженным и обладал бы свойством сильного окислителя. Однако, этого иона нет в природе и его синтезировать крайне сложно.
Валентность марганца
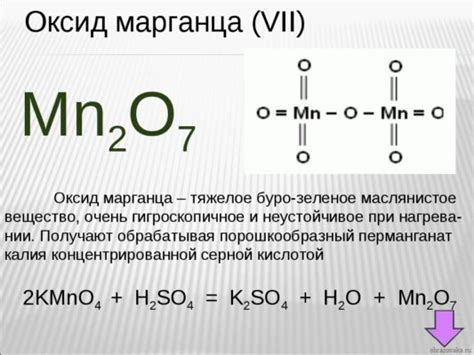
Однако, марганец не имеет валентности 5, хотя у переходных металлов, включая его соседей в периоде, такая валентность вполне возможна. Причина отсутствия валентности 5 у марганца связана с его электронной конфигурацией.
Марганец имеет электронную конфигурацию [Ar] 3d5 4s2, что означает наличие 7 электронов в валентной оболочке. Валентность элемента определяется числом свободных или доступных для связывания электронов во внешней оболочке. В случае марганца, количество доступных электронов составляет 7, что противоречит возможности образования соединений с валентностью 5.
Валентность марганца обычно составляет 2+, 3+ или 4+. Это связано с возможностью потери двух, трех или четырех электронов соответственно, чтобы достичь более стабильной электронной конфигурации. Марганец также может образовывать соединения с валентностью 6+, но это уже редкое явление.
Таким образом, валентность марганца ограничена определенными значениями и не включает в себя валентность 5. Это связано с его электронной конфигурацией и количеством доступных электронов во внешней оболочке.
Причины отсутствия валентности 5

Марганец имеет электронную конфигурацию [Ar] 3d5 4s2, что означает наличие 5 электронов в d-подуровне и 2 электронов в s-подуровне. При осуществлении химических реакций, марганец готов отдать или принять 2 или 3 электрона, в результате чего его валентность может составлять +2, +3, +4, +6 или +7.
Валентность 5 требовала бы наличия 5 электронов на d-подуровне, однако у марганца их всего 5, но при этом он уже образует стабильную конфигурацию 3d5, наподобие аргоновой. Следовательно, у марганца нет возможности образования соединений с валентностью 5.
Кроме того, валентность 5 присуща большинству переходных металлов, но у марганца она встречается крайне редко. Это обусловлено наличием у марганца относительно высокой энергии ионизации, что препятствует образованию соединений с валентностью 5.
Обладая различными валентностями, марганец является важным элементом в различных процессах ихимических реакциях, вплоть до участия в фотосинтезе и дыхании организмов.
Влияние электронной конфигурации
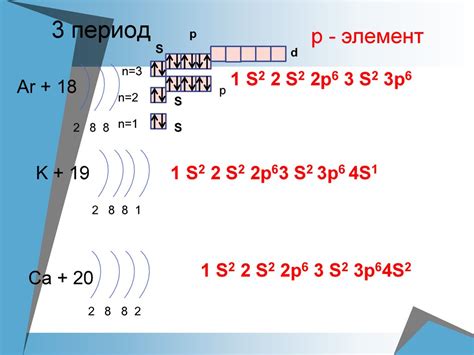
Марганец имеет атомный номер 25 и его электронная конфигурация: [Ar] 3d5 4s2. По схеме Маделиунга, первые три электрона атома марганца входят в оболочку 1s2, следующие восемь электронов располагаются в оболочке 2s22p6, а остальные в оболочках 3d5 и 4s2.
Как видно из электронной конфигурации, валентная оболочка марганца – это 4s2. Согласно правилу главного квантового числа, эта оболочка может вместить максимум 2 электрона. Именно поэтому марганец имеет валентность 2, а не 5.
Если бы все электроны в оболочке 3d были включены в химический связующий процесс, валентность марганца могла бы быть 5. Однако, нарушение правила главного квантового числа сопровождается нестабильностью вещества и не энергетически выгодно.
Электронная конфигурация определяет не только валентность атома, но и его химические свойства. Поэтому марганец с электронной конфигурацией [Ar] 3d5 4s2 обладает свойствами переходного металла и широко применяется в различных отраслях промышленности и научных исследованиях.
Химические свойства марганца

Первое химическое свойство марганца - его способность образовывать соединения с различными элементами. Например, марганец может образовывать соединения с кислородом, серой, фосфором и другими элементами. Эти соединения обладают различными свойствами и широко используются в различных отраслях промышленности.
Второе химическое свойство марганца - его окислительные свойства. Марганец может выступать как окислителем и восстанавливаться в процессе химических реакций. Например, марганцовые соединения могут окисляться до более высоких оксидов или вступать в реакции восстановления. Эта особенность марганца широко используется в производстве стали, при производстве батарей и других промышленных процессах.
Третье химическое свойство марганца - его способность образовывать комплексные соединения. Марганец может образовывать комплексы с различными лигандами, такими как аммиак, хлорид, нитрат и другие. Эти комплексы обладают уникальными свойствами и находят применение в качестве катализаторов, пигментов и других химических соединений.
Химические свойства марганца обусловлены его электронной конфигурацией и положением в периодической системе элементов. Этот элемент имеет валентность от +2 до +7, но не имеет валентности 5. Это связано с особенностями распределения электронов в атоме марганца и правилами заполнения энергетических уровней. Валентность марганца напрямую влияет на его химические свойства и способность образовывать соединения с другими элементами.
Марганец: окислитель или восстановитель?

Марганец обычно находится в форме двухвалентного и трехвалентного катионов. Двухвалентный марганец (Mn2+) имеет возможность участвовать в окислительно-восстановительных реакциях, меняя свою валентность. Однако его валентность не может быть равна 5, так как для этого требуется изменение валентности Mn2+ до Mn5+ - процесс, который является энергетически не выгодным и затруднительным.
В обычных условиях марганец может быть окислителем и восстановителем. Например, в кислотных условиях он способен окислять соединения в более высокую степень окисления, а в щелочных условиях он может восстанавливать соединения до более низкой степени окисления.
Важно отметить, что валентность марганца зависит от конкретных условий реакции и соединений, с которыми он взаимодействует. Этот элемент широко применяется в различных отраслях промышленности, включая производство стали, производство батарей и производство стекла.
Роль марганца в природе

В первую очередь, марганец является необходимым микроэлементом для многих живых организмов. В небольших количествах он участвует в обмене веществ, способствует правильному образованию костей и хорошей работе иммунной системы. Без наличия марганца здоровье человека может существенно пострадать.
Кроме того, марганец играет важную роль в почвообразовании и питании растений. Он является важным компонентом плодородных почв и способствует активному росту и развитию растений. Марганец необходим для синтеза хлорофилла, который является основным веществом, позволяющим растениям проводить фотосинтез.
Кроме того, марганец широко используется в промышленности. Он находит применение в производстве стали, а также в производстве батарей, сплавов и других материалов. Марганцевые сплавы обладают высокой прочностью и стойкостью к коррозии, что делает их очень популярными в различных отраслях промышленности.
Таким образом, роль марганца в природе невозможно переоценить. Этот химический элемент играет важную роль в поддержании здоровья людей и живых организмов, обеспечивает нормальное функционирование почв и растений, а также находит широкое применение в промышленности.