Атомы, хотя и являются основными строительными блоками всех веществ, в твердых телах не распадаются на отдельные единицы. Это фундаментальное свойство твердых тел, которое обусловлено силами, действующими между атомами и молекулами.
Твердое тело представляет собой систему атомов или молекул, которые существуют в состоянии равновесия. Именно эти силы препятствуют разрушению твердого тела и обеспечивают его прочность и устойчивость. Атомы внутри твердого тела тесно связаны друг с другом и не могут свободно перемещаться.
В твердых телах на межатомном расстоянии существуют силы электростатического и ван-дер-ваальсова взаимодействия, а также силы связи соседних атомов, которые держат их на месте. Эти силы действуют в направлении, противоположном движению атомов и препятствуют их разделению.
Кроме того, в твердых телах могут существовать различные формы связи между атомами, такие как ковалентная связь, ионная связь и металлическая связь. Все эти виды связей имеют свои особенности и обеспечивают высокую прочность и стабильность твердого тела.
Устойчивая связь между атомами
В большинстве твердых тел атомы находятся в плотной упаковке и находятся в постоянном движении. Это обеспечивается силами, действующими между атомами. Главной силой является электростатическое взаимодействие между электронами одного атома и электрическими зарядами других атомов. Эти взаимодействия создают сильные связи, которые держат атомы вместе и помогают твердым телам сохранить свою структуру.
Чтобы лучше понять устойчивую связь между атомами, можно рассмотреть пример кристаллической решетки. В кристаллических твердых телах атомы упорядочены в регулярную структуру, называемую решеткой. Каждый атом занимает определенное место в решетке и имеет своих соседей. Эти соседи оказывают влияние на атомы и создают сильные взаимодействия, которые делают твердое тело стабильным и устойчивым.
Сильная связь между атомами также объясняет, почему твердые тела имеют определенные физические и химические свойства. Например, металлы обладают высокой прочностью и теплопроводностью благодаря сильным связям между металлическими атомами. Кристаллы соль имеют яркий цвет из-за особенностей электронной структуры связанных атомов.
Таким образом, устойчивая связь между атомами играет ключевую роль в том, что твердые тела не распадаются на отдельные атомы. Это явление объясняет прочность, стабильность и характерные свойства твердых тел, исходя из взаимодействий между атомами.
Силы притяжения
Атомы в твердом теле совместно создают электромагнитные силы притяжения, которые удерживают их на своих местах. Эти силы притяжения происходят из электромагнитного взаимодействия между электронами и ядрами атомов.
Электроны, находящиеся внутри атомов, обладают отрицательным электрическим зарядом, в то время как ядра атомов имеют положительный заряд. В результате этого электростатического взаимодействия между зарядами, силы притяжения держат атомы вместе и предотвращают их разрушение.
Кроме того, силы притяжения между атомами в твердом теле могут быть усилены благодаря другим факторам, таким как межмолекулярные связи и взаимодействие между диполями. Эти дополнительные механизмы укрепляют взаимодействие между атомами и делают твердые тела более устойчивыми.
Таким образом, силы притяжения между атомами являются основной причиной, по которой твердые тела не распадаются на отдельные атомы. Эти силы создают прочность и стабильность внутри твердого тела, что позволяет сохранять его форму и структуру.
Кристаллическая структура
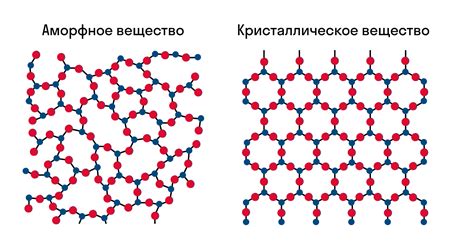
Кристаллическая структура твердого тела может быть представлена в виде трехмерной решетки из атомов или молекул, которые соединены между собой сильными химическими связями. Эти связи обеспечивают стабильность и прочность материала.
| Примеры кристаллических структур | Особенности |
|---|---|
| Кубическая решетка | Атомы расположены на вершинах и в центрах граней куба. Эта структура встречается, например, у кристаллов соли. |
| Гексагональная решетка | Атомы расположены в шестиугольниках, образуя шестиугольную решетку. Эта структура встречается, например, у графита. |
| Тетрагональная решетка | Атомы расположены вдоль осей x и y, образуя параллелограммальную решетку. Эта структура часто встречается в различных металлах. |
Кристаллическая структура обеспечивает прочность и устойчивость твердых тел, так как атомы находятся в устойчивом равновесии друг с другом. Они не могут просто "самостоятельно" оторваться от решетки и распасться на отдельные атомы.
Кроме кристаллической структуры, также важным фактором является энергия связи между атомами или молекулами. Если энергия связи достаточно высокая, то материал будет иметь высокую прочность и устойчивость, и не будет распадаться на отдельные атомы при нормальных условиях.
Энергетический барьер
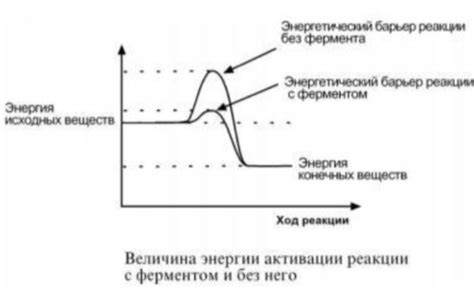
Чтобы атомы в твердом теле могли перемещаться, они должны преодолеть энергетический барьер. Энергетический барьер представляет собой потенциальную энергию, которую атомы должны получить, чтобы покинуть свое место в решетке и переместиться в другую позицию.
Для преодоления этого барьера атомам нужно получить достаточно энергии. Один из способов предоставления энергии - это нагревание твердого тела. При нагревании атомы начинают вибрировать с большей амплитудой, что увеличивает их энергию и способствует перемещению по решетке.
Однако, даже при высоких температурах существует вероятность, что атомы вернутся на свои места, так как энергетический барьер является тем меньше, чем более стабильна структура решетки. Твердые тела обладают кристаллической структурой, которая обычно обладает высокой стабильностью, что делает их устойчивыми.
Исключение составляют аморфные твердые тела, где структура не имеет четкой кристаллической формы. В аморфных твердых телах энергетические барьеры могут быть ниже, поэтому атомы имеют большую свободу перемещения и быстрее распадаются на отдельные частицы.
Потенциальная энергия
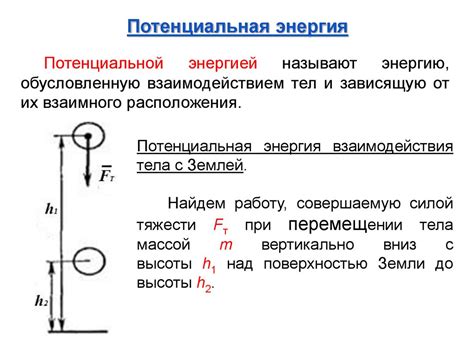
В твердых телах атомы и молекулы сильно связаны в кристаллической решетке и обладают потенциальной энергией. Потенциальная энергия возникает из-за притяжения и отталкивания частиц друг от друга, а также из-за их внутренней структуры и взаимодействия электронов и ядер.
Силы притяжения и отталкивания между атомами зависят от их расстояния и характеристик электронных облаков. Если расстояние между атомами изменяется, меняется и сила взаимодействия. Когда атомы находятся в равновесии и подвергаются внешним силам, они совершают колебания вокруг положения равновесия, и энергия колебательных движений превращается в потенциальную энергию.
Потенциальная энергия также может возникать из-за деформации тела. Если твердое тело подвергается давлению или нагрузке, его атомы и молекулы смещаются относительно своего равновесного положения, что приводит к возникновению потенциальной энергии деформации.
Именно благодаря потенциальной энергии и силам взаимодействия твердые тела сохраняют свою структуру и не распадаются на отдельные атомы. Потенциальная энергия позволяет атомам и молекулам сохранять определенное положение в кристаллической решетке и обуславливает их стабильность.
Активация
Активация – это процесс, при котором твердое тело начинает разлагаться на отдельные атомы или молекулы. При этом, связи между атомами или молекулами внутри твердого тела ослабевают или полностью разрушаются, и атомы или молекулы освобождаются из структуры твердого тела в виде газа или пара.
Активация может происходить под воздействием высоких температур, когда молекулярные движения в твердом теле становятся достаточно интенсивными, чтобы разрушить связи между атомами или молекулами. Также, активация может быть вызвана воздействием электрического поля, которое может изменять заряд атомов или молекул и тем самым ослаблять их связи.
Активация твердых тел может иметь как положительные, так и отрицательные последствия. Например, в некоторых случаях активация может быть полезной, позволяя освободить ценные элементы, содержащиеся в твердом теле, или улучшить его электрические свойства. Однако, в других случаях активация может приводить к разрушению структуры твердого тела и его деградации.
Фазовые переходы
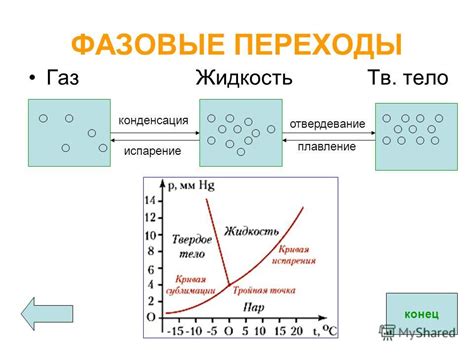
Один из видов фазовых переходов, которые могут происходить с твердыми телами, - это плавление. При повышении температуры твердое тело может пройти в жидкое состояние. Во время плавления, атомы или молекулы начинают двигаться более свободно и порядок в структуре теряется. Однако, при охлаждении до определенной температуры, жидкость может снова стать твердым телом.
Еще один вид фазового перехода - это сублимация. Сублимация происходит, когда твердое тело прямо переходит в газовую фазу без прохождения через жидкий состав. Примером сублимации может быть превращение льда в водяной пар при низкой температуре и атмосферном давлении.
Фазовые переходы определяются термодинамикой и зависят от взаимодействия между атомами или молекулами вещества. Когда условия меняются, энергия вещества может изменяться, что приводит к переходам между различными фазами вещества. Твердые тела обладают достаточной стабильностью и прочностью своей структуры, чтобы не распадаться на отдельные атомы или молекулы при стандартных условиях.