Кипение воды – это один из самых знакомых и ежедневных процессов, который происходит, когда вода достигает определенной температуры и переходит из жидкого состояния в парообразное. Но почему именно при 100 градусах Цельсия вода начинает кипеть? В этой статье мы рассмотрим причины и объясним этот феномен.
Одной из основных причин, по которой вода кипит при 100 градусах, является атмосферное давление. Когда вода нагревается, ее молекулы начинают двигаться быстрее и раздвигаться, что создает давление на стенки сосуда, в котором она находится. При повышении температуры давление воды становится все больше и больше.
Однако, при атмосферном давлении в 1 атмосферу, вода уже начинает кипеть при 100 градусах Цельсия. Это происходит потому, что при данной температуре давление водяного пара становится равным атмосферному давлению. Когда эти давления сравниваются, молекулы воды образуют пузырьки пара, которые выбираются на поверхность и вызывают характерные пузырьки и шум, связанные с кипением.
Прежде чем достичь точки кипения, вода проходит через несколько других стадий. Сначала, при нагревании, вода прогревается до определенной температуры, называемой точкой плавления. Вода остается жидкой, но молекулы становятся более подвижными.
Затем происходит превращение воды в парообразное состояние. Сначала это происходит на поверхности жидкости, где молекулы с достаточной энергией покидают жидкую фазу и переходят в газообразную. Это называется испарением. Затем, когда вода достигает точки кипения, переход в парообразное состояние становится все более активным и образуется водяной пар.
Почему вода кипит при 100 градусах

Процесс кипения воды, при котором она переходит из жидкого состояния в газообразное, имеет особое значение для людей и множество практических применений.
Основным фактором, определяющим точку кипения воды, является атмосферное давление. При нормальных условиях (атмосферное давление 1 атмосфера) вода кипит при температуре 100 градусов Цельсия.
При повышении давления, точка кипения воды повышается, а при понижении - понижается. Например, в горах, на высоте, где атмосферное давление ниже, вода будет кипеть уже при более низких температурах.
Кипение происходит из-за сил притяжения и удержания молекул в веществе. В жидкости молекулы находятся близко друг к другу и взаимодействуют слабыми силами, называемыми взаимодействием Ван-дер-Ваальса. При нагревании вещество получает энергию и молекулы начинают двигаться быстрее. Когда энергия молекул преодолевает силы притяжения, они становятся в состоянии настолько энергичными, что вырываются из воды и образуют пар. Это и есть процесс кипения.
Температура кипения воды является константой при определенных условиях и позволяет нам контролировать нагревание и готовку пищи.
Таким образом, кипение воды при 100 градусах обусловлено взаимодействием молекул воды и атмосферным давлением. Понимание этих факторов помогает нам использовать воду при готовке и других процессах, связанных с ее кипением.
Физические свойства воды
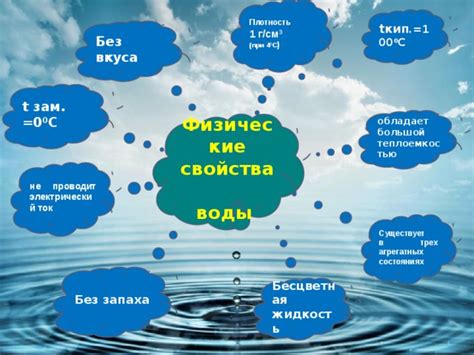
Температура кипения – одно из важных физических свойств воды. При нормальных условиях, при атмосферном давлении, вода начинает кипеть при 100 градусах Цельсия.
Температура кипения воды имеет большое значение, так как с ее помощью можно совершать такие процессы, как приготовление пищи, стерилизация, сушка и другие.
Причина, по которой вода кипит при 100 градусах, заключается в особых физических свойствах молекул воды. Вода обладает высокими межмолекулярными взаимодействиями – водородными связями.
Вода образует структуру, в которой молекулы воды связаны между собой водородными связями. В этой структуре вода образует кластеры и обволакивает другие молекулы веществ. Когда вода нагревается, молекулы воды получают больше энергии и движутся быстрее. При достижении определенной температуры они обрывают водородные связи и вода переходит в состояние пара – начинается кипение.
Таким образом, физические свойства воды, включая температуру кипения, определяются взаимодействием молекул воды и их структурой. Поэтому вода имеет такую высокую температуру кипения, что делает ее удобной и необходимой для множества процессов в нашей повседневной жизни.
Влияние атмосферного давления
При повышении атмосферного давления температура, при которой вода кипит, повышается, а при его снижении – понижается. Это связано с тем, что давление влияет на температуру, при которой пар плавится в воде. Когда атмосферное давление высоко, пары воды могут существовать только при более высокой температуре, чтобы создать достаточное давление, чтобы преодолеть атмосферное давление и выйти в атмосферу в виде пара. И наоборот, когда атмосферное давление низкое, пары воды могут существовать при более низкой температуре, так как давление не так сильно давит на воду.
Поэтому, при нормальном атмосферном давлении, вода начинает кипеть при температуре 100 градусов Цельсия. Однако, в более высоких или низких условиях атмосферного давления, температура кипения воды может быть выше или ниже 100 градусов Цельсия.
Молекулярная структура воды
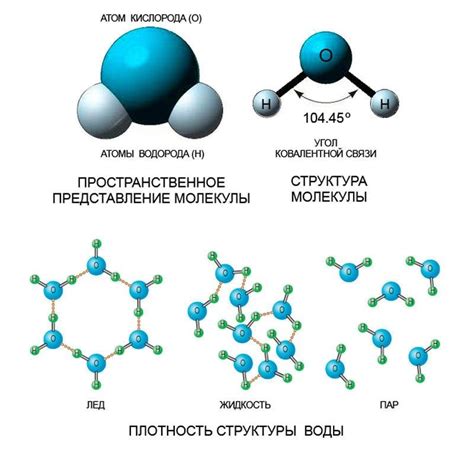
Молекула воды имеет форму геометрического тетраэдра, где атом кислорода находится в центре, а атомы водорода расположены по обеим сторонам атома кислорода. Угол между атомами водорода составляет около 104,5 градусов. Эта уникальная форма молекулы воды обуславливает ее химические и физические свойства.
Молекулы воды обладают полярностью, что означает, что они имеют неравномерное распределение зарядов. Атом кислорода привлекает большую часть электронной оболочки, что делает его негативно заряженным, а атомы водорода остаются положительно заряженными. Это приводит к образованию положительного и отрицательного полюсов в молекуле воды.
Именно поларность молекул воды обуславливает такие важные свойства, как высокая теплоемкость и высокая теплопроводность. Молекулы воды способны образовывать водородные связи - слабые электростатические притяжения между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом кислорода другой молекулы. Это позволяет молекулам воды быть связанными и образовывать структуры, такие как лед, снег и плотина.
Также поларность молекулы воды обусловливает ее способность растворять различные вещества. Молекулы воды образуют оболочку вокруг заряженных или полярных молекул, удерживая их в растворе. Это делает воду хорошим растворителем для солей, кислот, щелочей и многих органических веществ.
Тесная упаковка молекул воды также обеспечивает ее высокую плотность в жидком состоянии. Это означает, что молекулы воды находятся ближе друг к другу и могут взаимодействовать с большей силой по сравнению с газообразными веществами.
Молекулярная структура воды играет важную роль в термодинамических и химических процессах, которые происходят в природе, включая кипение воды при 100 градусах Цельсия. При нагревании, молекулы воды приобретают достаточную энергию, чтобы преодолеть взаимодействие между ними и перейти в паровую фазу, что и вызывает кипение.
Равновесие фаз воды
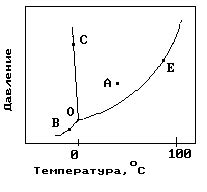
Кипение - это процесс перехода воды из жидкой фазы в газообразную при достижении определенной температуры, которая называется точкой кипения. Для воды точка кипения при нормальных условиях составляет 100 градусов по Цельсию.
Вода имеет свойство кипеть при 100 градусах именно при нормальных условиях из-за взаимодействия между ее молекулами. Когда вода нагревается, энергия передается молекулам, и они начинают двигаться быстрее. При достижении определенной температуры, которая соответствует точке кипения, энергия становится достаточной для разрыва связей между молекулами воды.
Во время кипения, нагреваемая вода превращается в пар, и его молекулы распространяются в воздухе вокруг. Этот процесс называется испарением. Когда молекулы пара достигают равновесия с молекулами воды, происходит конденсация, и вода снова превращается в жидкость.
Точка кипения воды зависит от давления: при повышении давления точка кипения повышается, а при понижении давления - снижается. Например, на высоте над уровнем моря точка кипения воды ниже, так как давление воздуха там ниже. Это объясняет, почему вода может кипеть при нижних температурах в горных регионах.
Зависимость температуры кипения от высоты над уровнем моря
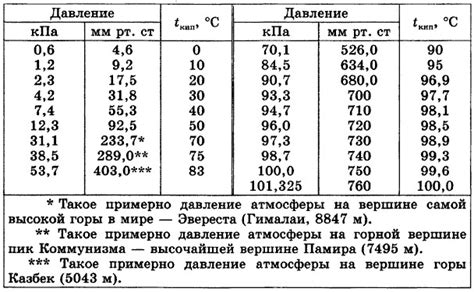
Температура кипения воды, как известно, составляет 100 градусов Цельсия на уровне моря при атмосферном давлении. Однако, с увеличением высоты над уровнем моря, давление атмосферы снижается, и, как следствие, температура кипения уменьшается.
Это явление объясняется тем, что кипение воды происходит, когда насыщенный паровой слой над поверхностью жидкости создает достаточное давление, чтобы преодолеть атмосферное давление. При понижении атмосферного давления, паровому слою требуется меньше энергии для достижения нужного давления, и потому вода начинает кипеть при более низких температурах.
Таблица ниже показывает зависимость температуры кипения от высоты над уровнем моря:
| Высота над уровнем моря | Температура кипения воды |
|---|---|
| 0 м | 100°C |
| 500 м | 99.2°C |
| 1000 м | 98.4°C |
| 1500 м | 97.7°C |
| 2000 м | 97.0°C |
Как видно из таблицы, с увеличением высоты над уровнем моря температура кипения воды уменьшается примерно на 0.8 градуса Цельсия на каждые 500 метров.
Знание о зависимости температуры кипения от высоты над уровнем моря имеет практическое значение, например, при готовке пищи в горной местности. Важно учитывать изменение температуры кипения, чтобы получить желаемый результат.
Роль наличия примесей в воде

Наличие примесей в воде может оказывать значительное влияние на ее кипение. Изначально вода начинает кипеть при температуре 100 градусов по Цельсию, однако, при наличии примесей этот процесс может происходить при более высоких или более низких температурах.
Примеси могут изменить физические свойства воды, включая ее поверхностное натяжение итеплопроводность. Если вода содержит примеси, то уровень ее поверхностного натяжения может увеличиться, что приводит к необходимости нагревать ее до более высокой температуры, чтобы достичь точки кипения.
Кроме того, примеси могут повлиять на теплопроводность воды. Если вода содержит растворенные соли или другие вещества, они могут увеличить ее плотность и теплопроводность. Это означает, что тепло будет распространяться по воде более эффективно, что в свою очередь может привести к более быстрому кипению.
Наличие примесей в воде также может ускорять или замедлять образование пузырьков пара, которые являются начальной стадией кипения. Например, некоторые вещества могут способствовать образованию пузырьков, тем самым ускоряя кипение. В то же время, другие вещества могут оказывать обратное действие и замедлять образование пузырьков пара.
Таким образом, наличие примесей в воде играет важную роль в ее кипении. Оно может повлиять на поверхностное натяжение и теплопроводность воды, а также на образование пузырьков пара. Все эти факторы могут изменять точку кипения воды и влиять на скорость процесса кипения.