Зимой, когда температура снаружи падает до минусовых значений, многие водоемы покрываются льдом. Но что интересно, вода, которая скрыта под этим ледяным покровом, не замерзает. Почему так происходит? Ведь, казалось бы, вода должна стать твердой при понижении температуры до нуля градусов по Цельсию. Давайте попробуем разобраться в этом феномене.
Первая причина, по которой вода подо льдом не замерзает, связана с теплоемкостью воды. Вода обладает высокой теплоемкостью, что означает, что она способна поглощать и отдавать большое количество тепла без существенного изменения своей температуры. Когда температура окружающей среды начинает понижаться, вода подо льдом начинает отдавать свое тепло окружающей среде и, таким образом, поддерживает свою собственную температуру выше нуля градусов.
Вторая причина, по которой вода подо льдом не замерзает, связана с плотностью воды. Большинство веществ сжимается при охлаждении, но вода является исключением. Она сжимается при охлаждении до температуры около 4 градусов по Цельсию, а ниже этой температуры она начинает расширяться. Поэтому, когда вода подо льдом остывает до околонулевой температуры, она расширяется и образует более плотную и тяжелую структуру, так называемый лед. Этот лед остается на поверхности воды, а ниже него остается маленький слой незамерзшей воды.
Почему вода подо льдом не замерзает
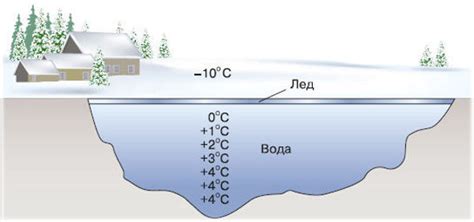
Это явление объясняется тем, что вода обладает высокой удельной теплоемкостью и теплопроводностью. Удельная теплоемкость воды означает, что количество теплоты, необходимое для нагрева единицы массы воды на один градус, очень большое. Теплопроводность воды позволяет ей передавать тепло в окружающую среду.
Когда температура окружающей среды падает и вода охлаждается, она начинает сжиматься и становится плотнее. Когда вода достигает температуры 0 градусов Цельсия, она переходит в лед, а объем воды увеличивается. Структура льда состоит из регулярно упорядоченных молекул, которые занимают больше места, чем молекулы воды в жидком состоянии.
Когда вода замерзает, образуется тонкий слой льда на поверхности. Этот слой помогает изолировать оставшуюся воду от холодного воздуха и уменьшает передачу тепла. Таким образом, тепло, выделяемое в ходе замерзания, задерживается в окружающей лед среде.
Из-за этих уникальных свойств вода подо льдом может оставаться жидкой, даже когда температура воздуха ниже нуля градусов Цельсия. Это играет важную роль в поддержании жизни под льдом, так как позволяет существам выживать в непроходимых условиях зимнего холода.
Научное объяснение

Почему вода подо льдом не замерзает? Ответ на этот вопрос лежит в особенностях структуры и свойствах воды.
Вода является уникальным веществом, так как ее молекулы образуют особую трехмерную структуру, называемую решеткой. В этой решетке каждая молекула воды связана гидрофильными связями с соседними молекулами. Эти связи обладают сильной энергией, что делает воду структурно устойчивой.
Когда температура воды падает, ее молекулы начинают двигаться медленнее. При достижении температуры замерзания, которая составляет 0 градусов Цельсия, молекулы организуются в кристаллическую решетку льда. В этой решетке связи между молекулами воды принимают более упорядоченную форму.
Однако, когда вода находится под слоем льда, она находится в контакте как с атмосферой, так и с самим льдом. Из-за перехода тепла между водой и льдом, температура воды под льдом поднимается незначительно. Это значение близко к нулю, что позволяет воде оставаться в жидком состоянии.
Кроме того, лед является плохим теплопроводником, поэтому он плохо передает тепло воде под ним. Это дополнительно способствует поддержанию жидкого состояния воды.
Таким образом, научное объяснение тому, почему вода под льдом не замерзает, заключается в специальных свойствах структуры воды и в относительно малом переходе тепла между льдом и водой. Это позволяет воде сохранять свое жидкое состояние под слоем льда даже при низких температурах.
Особенности молекул воды
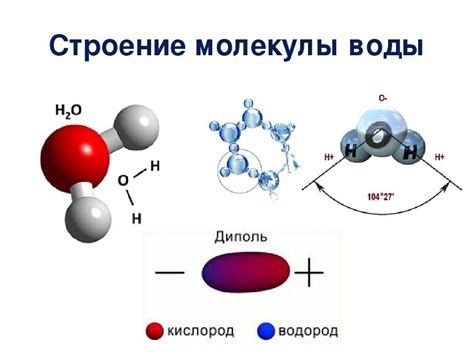
| Особенность | Объяснение |
|---|---|
| Высокая кипящая и таящая температура | Это связано с присутствием межмолекулярных водородных связей, которые требуют дополнительной энергии для разрыва, что приводит к повышенному кипению и таянию воды. |
| Поверхностное натяжение | За счет водородных связей между молекулами воды, они притягиваются друг к другу, образуя поверхностную пленку, которая демонстрирует свойство натягиваться и удерживаться. |
| Высокая плотность в жидком состоянии | Молекулы воды в жидком состоянии плотно упаковываются благодаря взаимодействиям через водородные связи, что делает воду тяжелой по сравнению с другими жидкостями. |
Все эти особенности молекул воды способствуют тому, что лед образует открытую кристаллическую решетку, что делает его менее плотным и позволяет воде находиться в жидком состоянии даже при низких температурах.
Изменение точки замерзания
Одна из уникальных свойств воды заключается в том, что она изменяет свою точку замерзания при наличии определенных условий.
В нормальных условиях вода замерзает при температуре 0 градусов Цельсия. Но если добавить в воду определенные вещества, такие как соль или сахар, то это может изменить ее свойства и снизить точку замерзания.
Это происходит потому, что добавление веществ в воду создает эффект колебания, который мешает образованию кристаллов льда. В результате точка замерзания воды снижается, и она может оставаться в жидком состоянии при температурах ниже нуля градусов Цельсия.
Изменение точки замерзания воды имеет практическое применение в нашей повседневной жизни. Например, дороги посыпают солью в холодное время года, чтобы предотвратить образование гололеда. Соль снижает точку замерзания воды, что позволяет ей оставаться жидкой при низких температурах.
Изменение точки замерзания воды также используется при приготовлении пищи. Добавление соли или сахара в воду, в которой варятся овощи или макароны, помогает им сохранять свою структуру и не замерзать.
Таким образом, изменение точки замерзания воды играет важную роль в нашей жизни и находит применение в различных сферах, от дорожного строительства до кулинарии.
Давление и замерзание

Взаимодействие воды с внешним давлением может быть проиллюстрировано с помощью простого эксперимента. Если взять закрытую пластиковую бутылку с водой и поместить ее в морозильник, то при замерзании вода начнет расширяться и создавать давление внутри бутылки. В результате этого давления лед не сможет образоваться, и вода останется в жидком состоянии, несмотря на низкую температуру.
Как только давление снимается или уменьшается, энергия образования льда освобождается, и вода моментально замерзает. Например, если открыть крышку на бутылке с замерзшей водой, то лед быстро начнет формироваться и заполонит всю емкость.
Таким образом, давление играет важную роль в сохранении воды в жидком состоянии подо льдом. Это объясняет, почему даже при очень низких температурах водоемы, покрытые льдом, не замерзают полностью и сохраняют жизнь под водой.
| Преимущества давления | Недостатки давления |
|---|---|
| Предотвращение замерзания воды | Вода может оставаться жидкой при низких температурах только при наличии давления |
| Сохранение подводной жизни | Давление может вызывать проблемы для структур и оборудования, подвергнутых водному давлению |
Термодинамические факторы
Понимание того, почему вода подо льдом не замерзает, связано с особенностями термодинамики и взаимодействия молекул.
Вода является уникальным веществом, так как она имеет наибольшую плотность при температуре 4 градуса Цельсия. При дальнейшем охлаждении воды, снижение температуры и образование льда происходит неоднородно.
Это связано с тем, что молекулы воды имеют дипольные связи, которые подвергаются влиянию взаимодействия соседних молекул. При охлаждении вода начинает становиться все более структурированной, и молекулы воды начинают образовывать кристаллическую решетку, которая приводит к образованию льда.
Однако при наличии льда на поверхности воды термодинамические факторы начинают играть важную роль. Под ледяной поверхностью вода оказывается отделена от окружающего пространства, и температура воды оказывается ближе к 0 градусов Цельсия. Это делает образование льда менее вероятным, так как для этого требуется еще большее понижение температуры.
Кроме того, лед служит так называемым теплоизолятором, предотвращая утечку тепла из воды в окружающую среду. Это позволяет воде оставаться в жидком состоянии под льдом.
Таким образом, термодинамические факторы играют решающую роль в том, почему вода подо льдом не замерзает, и помогают поддерживать жизнь в подводных экосистемах в условиях холодной зимы.
Эффекты растворения

Вода подо льдом не замерзает благодаря ряду физических и химических эффектов, которые происходят при растворении различных веществ в воде.
1. Теплота растворения. Когда вещество растворяется в воде, происходит выделение или поглощение тепла. При растворении солей, например, происходит выделение теплоты, что помогает поддерживать температуру воды выше точки замерзания.
2. Снижение температуры замерзания. Вода с растворенными в ней веществами имеет более низкую температуру замерзания по сравнению с чистой водой. Это происходит из-за изменения кристаллической структуры воды и наличия растворенных ионов, которые мешают образованию льда.
3. Давление. Растворенные вещества влияют на давление жидкости. Это может приводить к увеличению давления на поверхности воды подо льдом и предотвращать ее замерзание.
4. Распределение ионов. Ионы, растворенные в воде, могут мигрировать и перемещаться внутри жидкости. Это может иметь влияние на температуру замерзания воды и предотвращать ее замерзание.
5. Взаимодействие молекул. Растворенные молекулы и ионы могут взаимодействовать с молекулами воды, что изменяет их упорядоченность и помогает предотвратить замерзание воды.
Вместе эти эффекты создают уникальное состояние, когда вода подо льдом остается в жидком состоянии при низких температурах. Это имеет важное значение для сохранения жизни в водных экосистемах во время зимнего периода.