Вода - одно из самых распространенных и важных веществ на Земле. Она существует в трех агрегатных состояниях: водяной пар (газ), жидкость и лед (твердое состояние). Почему же вода является жидкостью?
Ответ кроется в структуре молекулы воды. Каждая молекула воды состоит из двух атомов водорода (H) и одного атома кислорода (O), соединенных между собой ковалентной связью. Благодаря своей уникальной форме и полярности, молекула воды обладает рядом особенностей, отличающих ее от большинства других веществ.
Действительно, молекула воды имеет форму угла, в котором кислородный атом находится между двумя атомами водорода. Благодаря этому, молекулы воды обладают полярностью - они имеют неравномерное распределение зарядов.
В результате, молекулы воды взаимодействуют между собой с помощью слабых водородных связей. Эти связи возникают между положительно заряженным водородным атомом одной молекулы и отрицательно заряженным кислородным атомом другой молекулы. Именно наличие водородных связей делает воду жидкостью при нормальных условиях температуры и давления.
Вода - лучший растворитель

Вода является полярным молекулой, то есть ее атомы обладают неравномерно распределенными зарядами. Это отличает ее от других жидкостей, в том числе аммиака, который является неполярным газом. Благодаря полярности, вода способна притягивать другие полярные молекулы и ионы.
Молекулы воды образуют специальную структуру, называемую водным кластером. Эта структура позволяет воде образовывать взаимодействия с другими веществами. Когда вещество вступает в контакт с водой, молекулы воды образуют вокруг него водный оболочку, которая позволяет растворять и транспортировать различные вещества в организме.
| Преимущества воды в качестве растворителя: |
|---|
| 1. Широкий диапазон растворимости. Вода способна растворять различные вещества, в том числе соли, кислоты, щелочи и органические соединения. |
| 2. Уникальные растворительные свойства. Вода способна образовывать водородные связи с положительно и отрицательно заряженными частями молекул, что облегчает растворение веществ и их химические реакции. |
| 3. Наличие электролитов. Вода сама по себе является слабым электролитом и способна растворять различные ионы, что позволяет поддерживать основные биологические процессы в организме. |
Вода играет важную роль в жизнедеятельности всех организмов, в том числе людей. Она является основным компонентом клеток и тканей, а также участвует в большинстве метаболических реакций. Благодаря своей уникальной растворительной способности, вода обеспечивает транспорт питательных веществ, гормонов и отходов в организме.
Таким образом, вода является лучшим растворителем благодаря своей полярности, способности образовывать водный кластер и обладания уникальными растворительными свойствами. Ее способность растворять различные вещества играет важную роль в химических и биологических процессах, обеспечивая жизнедеятельность организмов.
Особенности молекулярной структуры
Причина различного агрегатного состояния воды и аммиака заключается в их молекулярной структуре.
Молекула воды (H2O) состоит из двух атомов водорода (H) и одного атома кислорода (O), соединенных ковалентными связями. Между атомами воды действуют сильные полярные взаимодействия, так как атомы кислорода и водорода имеют различную электроотрицательность. Полярность молекулы воды приводит к образованию водородных связей. В результате этого водная молекула образует структуру с высокой упорядоченностью и плотностью.
Аммиак (NH3) органическое соединение, молекула которого состоит из одного атома азота (N) и трех атомов водорода (H). В отличие от молекулы воды, молекула аммиака не обладает полярностью. Взаимодействие между атомами аммиака является слабым и осуществляется за счет ван-дер-ваальсовых сил. Эти силы не могут поддерживать высокую упорядоченность и плотность, поэтому аммиак находится в газообразном состоянии при комнатной температуре и давлении.
Таким образом, различия в молекулярной структуре воды и аммиака приводят к разным физическим свойствам данных веществ, включая агрегатное состояние.
Водородная связь: секрет жидкости
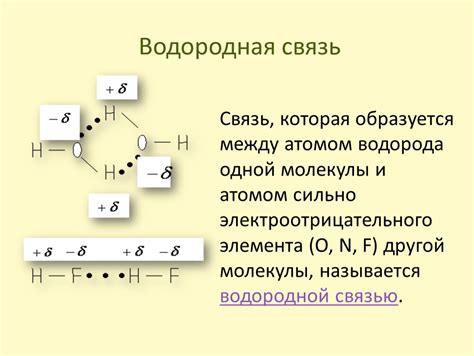
Водородная связь возникает, когда водородный атом, связанный с электроотрицательным атомом (например, атомом кислорода), образует слабую притяжение с другим электроотрицательным атомом. Эта связь намного слабее, чем ковалентная связь между атомами в молекуле воды, но она обладает специфическими свойствами, которые делают воду жидкостью при комнатной температуре и давлении.
Водородная связь обеспечивает структурность воды. В обычных условиях жидкая вода состоит из множества связанных между собой молекул. Каждая молекула воды может образовывать до четырех водородных связей с другими молекулами, что приводит к образованию 3D-структуры сетки, в которой молекулы воды связаны между собой. Именно водородные связи формируют плотную сеть межмолекулярных взаимодействий, делая воду более плотной, чем большинство других жидкостей.
Эти водородные связи также отвечают за многие уникальные физические свойства воды. Например, они обуславливают ее высокую плотность при 4 ° C, в результате чего лед "плавает" на поверхности воды. Водородные связи также отвечают за высокую теплопроводность и теплоемкость воды по сравнению с другими жидкостями.
Водородные связи играют ключевую роль во многих биологических процессах, так как они обеспечивают стабильную 3D-структуру большинства молекул белков и нуклеиновых кислот. Например, водородные связи между молекулами ДНК позволяют ей образовывать спиральную структуру двойной спирали, ключевую для ее функционирования.
Таким образом, водородная связь - секрет жидкости воды. Ее уникальные свойства, обусловленные этим видом химической связи, делают воду жизненно важной для всех известных живых организмов и придает ей особое место среди других жидкостей.
Теплоемкость воды: идеальное средство для устойчивого климата

Теплоемкость – это количество теплоты, которое необходимо передать веществу для его нагрева на единичную температурную разницу. У воды теплоемкость существенно выше, чем у других веществ, что делает ее эффективным участником в климатических процессах.
Что же предопределяет такую высокую теплоемкость воды? Во-первых, это межмолекулярные взаимодействия, силы притяжения между молекулами воды. В результате такого взаимодействия водные молекулы образуют сплоченные структуры, благодаря которым вода сохраняет свою жидкую форму при обычных условиях.
Во-вторых, это водородные связи. Водные молекулы образуют особые связи между атомами водорода и атомами кислорода соседних молекул. Такие связи являются внутримолекулярными, они прочны и требуют большого количества энергии для разрыва.
Уникальные свойства воды, основанные на ее высокой теплоемкости, оказывают важное влияние на климат Земли. Например, океаны и моря аккумулируют большое количество тепла от Солнца и передают его атмосфере, выравнивая разницу в температурах между днем и ночью, а также между сезонами.
Важную роль играет и водный парамах атмосферы. Благодаря высокой теплоемкости, вода в атмосфере способна задерживать и отдавать большое количество теплоты, что усиливает эффект парникового газа и поддерживает теплоту на Земле.
Таким образом, высокая теплоемкость воды является неотъемлемым свойством, позволяющим ей активно участвовать в климатических процессах и поспособствовать устойчивому климату нашей планеты.
Аммиак - уникальный газ

Во-первых, аммиак обладает высокой растворимостью в воде. Это означает, что он может легко смешиваться с водой и образовывать аммиачную воду. Это свойство делает аммиак не только удобным для хранения и транспортировки, но и позволяет использовать его в различных химических процессах и реакциях.
Во-вторых, аммиак имеет резкий и удушающий запах. Это делает его легко обнаружимым даже в небольших концентрациях. Благодаря этому свойству, аммиак используется в качестве запахового добавки в бытовых и промышленных средствах чистки, а также в сложных процессах контроля и безопасности.
Кроме того, аммиак является отличным растворителем для многих веществ. Он способен растворять ряд органических и неорганических соединений, делая его незаменимым компонентом в производстве химических реагентов, удобрений и лекарственных препаратов.
Наконец, аммиак обладает высокой теплопроводностью и теплоемкостью. Это означает, что он способен эффективно поглощать и передавать тепло. Благодаря этому свойству, аммиак применяется в производстве холодильных систем, а также в технологических процессах, связанных с нагреванием и охлаждением.
В итоге, аммиак является уникальным газом, который обладает широким спектром свойств и применений. Его удобство использования, высокая растворимость, химическая реакционность и теплопроводность делают его неотъемлемой частью современной промышленности и научных исследований.
Процесс сублимации: от твёрдого вещества до газа
Сублимация может происходить при низком давлении и высокой температуре, когда частицы твёрдого вещества обладают достаточной энергией для прямого перехода в газовую фазу. К примеру, аммиак (NH3) при комнатной температуре и атмосферном давлении находится в газообразном состоянии, так как его температура кипения (-33,34 °C) ниже комнатной температуры. Другие примеры веществ, которые подвержены сублимации, включают металлы, кристаллы и сухой лёд (твёрдый углекислый газ).
Сублимация является важным физическим процессом в различных областях. Она используется в лабораторных исследованиях, в производстве лекарственных препаратов, для создания ледяных эффектов в развлекательной индустрии и в других приложениях. Сублимация также может быть использована для очистки и консервации некоторых материалов, так как при этом процессе возникает сильное охлаждение, которое может убить микробов и насекомых, не повредив при этом материал.
Вода, в отличие от аммиака, не подвержена сублимации при стандартных условиях, так как её температура плавления (0 °C) ниже комнатной температуры. Вместо этого, при низких температурах вода переходит в твёрдое состояние непосредственно - процесс, известный как замерзание. Тем не менее, при достаточно низком давлении и температуре некоторое количество воды может сублимироваться в воздухе без появления жидкой воды.
Изучение сублимации позволяет лучше понять физические свойства различных веществ и применить их в различных областях, начиная от науки и инженерии до промышленности и медицины.
Аммиак: особенности взаимодействия с водой

Аммиак обладает полярными связями, где атом азота обладает отрицательным зарядом, а атомы водорода – положительным. Полярность молекулы аммиака приводит к образованию водородных связей между молекулой аммиака и молекулами воды. Молекулы аммиака притягиваются к молекулам воды, образуя гидратированные ионы аммония (NH4+) и гидроксида (OH-).
Гидратированный ион аммония может играть важную роль в биохимических процессах и обладает свойствами амфотерного соединения, то есть способен как принимать, так и отдавать протоны. Гидроксид аммония, образующийся в результате реакции аммиака с водой, является слабощелочным раствором, который можно наблюдать как аммиачную воду.
Взаимодействие аммиака с водой имеет значительное применение в различных областях, таких как производство удобрений, чистка поверхностей и дезинфекция.
Применение аммиака в различных отраслях

1. Производство удобрений. Аммиак является одним из основных компонентов для производства азотных удобрений. Благодаря своей высокой растворимости, аммиак позволяет растениям быстрее усваивать необходимый для их роста и развития азот.
2. Холодильная промышленность. Аммиак является эффективным хладагентом и используется в системах холодильного оборудования для охлаждения и морозильных камерах.
3. Производство пищевых продуктов. Аммиак может использоваться для удаления загрязнений и бактерий при производстве пищевых продуктов, таких как мясо и рыба.
4. Пищевая промышленность. Аммиак широко применяется для очистки и дезинфекции оборудования, используемого в производстве пищевых продуктов.
5. Производство промышленных химикатов. Аммиак является исходным продуктом для производства ряда промышленных химических веществ, таких как уксусная кислота, нитроэтан и другие.
Это только некоторые примеры использования аммиака в различных отраслях. Благодаря своим уникальным свойствам и широкому спектру применения, аммиак играет важную роль в современном промышленном процессе и продолжает находить новые области применения.
Возможные преимущества замены аммиака на воду
- Экологическая безопасность: Вода является более экологически безопасной альтернативой аммиаку. Аммиак может иметь отрицательное воздействие на окружающую среду и живые организмы при попадании в воду или воздух. Вода, с другой стороны, является естественным компонентом окружающей среды и обладает меньшими потенциальными негативными последствиями.
- Повсеместная доступность: Вода является наиболее распространенным веществом на Земле и легко доступна в больших количествах. Замена аммиака на воду в определенных процессах может уменьшить зависимость от ограниченных и дорогостоящих ресурсов аммиака и сделать процессы более доступными широкому кругу потребителей.
- Улучшенная безопасность: Вода, в отличие от аммиака, не является ядовитой и не представляет серьезной опасности при контакте с кожей или вдыхании паров. Замена аммиаковых систем на водяные системы может снизить риски для здоровья людей, работающих с этими веществами, и сократить необходимость в сложных мероприятиях безопасности.
- Повышенная эффективность: Вода обладает высокой теплоемкостью и теплопроводностью, что может улучшить эффективность процессов, в которых используется охлаждение или нагревание. Замена аммиака на воду может привести к повышению энергетической эффективности и более эффективному использованию ресурсов, что в свою очередь может привести к улучшению экономических показателей процессов.
Хотя замена аммиака на воду может иметь свои преимущества, следует учитывать также возможные ограничения и недостатки, связанные с конкретными процессами и условиями использования. Перед принятием решения об замене необходимо провести тщательный анализ и оценку всех аспектов, включая экологические, технические, экономические и безопасностные факторы.



