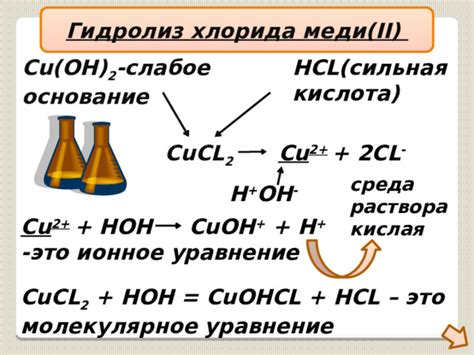
Хлорид меди (CuCl2) - это химическое соединение, состоящее из атомов меди и хлора. При определенных условиях, таких как взаимодействие с водой, хлорид меди подвергается процессу, известному как гидролиз.
Гидролиз - это химическая реакция, при которой соединение разбивается на ионы или молекулы под влиянием воды. В случае хлорида меди, гидролиз происходит ступенчато, то есть в несколько этапов.
На первом этапе хлорид меди превращается в гидроксид меди (Cu(OH)2), образуя ионы меди (Cu2+) и хлора (Cl-). Гидроксид меди образуется путем замещения ионов хлора в хлориде меди на ионы гидроксида из воды.
На втором этапе гидроксид меди продолжает гидролиз, разлагаясь на оксид меди (CuO) и воду (H2O). Этот процесс снова связан с дальнейшей заменой ионов гидроксида на ионы воды.
Ступенчатый гидролиз хлорида меди
| Ступень гидролиза | Уравнение реакции |
|---|---|
| Первая ступень | CuCl2 + H2O → CuCl + HCl |
| Вторая ступень | CuCl + H2O → Cu(OH)Cl + HCl |
| Третья ступень | Cu(OH)Cl + H2O → Cu(OH)2 + HCl |
На первой ступени гидролиза хлорид меди превращается в хлорид меди (I) и соляную кислоту. На второй ступени хлорид меди (I) гидролизуется со среженным количеством воды и образует гидроксохлорид меди (I) и соляную кислоту. На третьей ступени гидролиза гидроксохлорид меди превращается в гидроксид меди (II) и соляную кислоту.
Ступенчатый гидролиз хлорида меди происходит из-за наличия двухвалентной меди в структуре соединения. Медь (II) и медь (I) обладают разными кислотно-основными свойствами, поэтому при взаимодействии с водой образуются различные продукты гидролиза.
Ступенчатый гидролиз хлорида меди является важным процессом, который играет роль во многих химических реакциях, включая применение хлорида меди в качестве катализатора и его использование в электрохимических процессах.
Механизм гидролиза
Хлорид меди подвергается ступенчатому гидролизу в результате взаимодействия с водой. Этот процесс происходит поэтапно, образуя несколько промежуточных соединений. Изначально хлорид меди реагирует с водой, образуя гидрооксид меди (II), который далее претерпевает гидролиз и превращается в основную форму гидроксида меди (II).
Механизм гидролиза хлорида меди включает две основные реакции:
1. Хлорид меди (CuCl₂) реагирует с водой (H₂O) и образует гидрооксид меди (II) (Cu(OH)Cl) и соляную кислоту (HCl):
CuCl₂ + 2H₂O → Cu(OH)Cl + 2HCl
2. Гидрооксид меди (II) (Cu(OH)Cl) далее гидролизуется, образуя основный гидроксид меди (II) (Cu(OH)₂) и дополнительную соль (CuCl₂):
Cu(OH)Cl + H₂O → Cu(OH)₂ + HCl
Таким образом, происходит последовательное превращение хлорида меди в гидрооксид и гидроксид меди (II). Этот ступенчатый механизм гидролиза обусловлен различием в стабильности между промежуточными соединениями и конечным продуктом.
Химические реакции гидролиза
Одной из наиболее известных гидролитических реакций является гидролиз солей. Водные растворы многих солей могут обладать кислотными или щелочными свойствами. При контакте с водой, эти соли подвергаются гидролизу, что приводит к образованию кислоты или щелочи. К примеру, хлорид меди (CuCl2) подвергается ступенчатому гидролизу и в растворе образуется серная кислота (H2SO4) и гидроксид меди (CuOH).
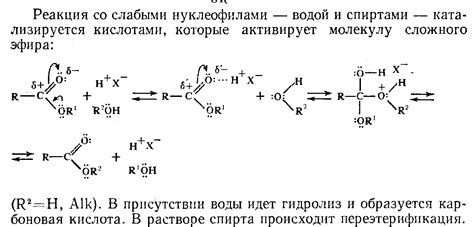
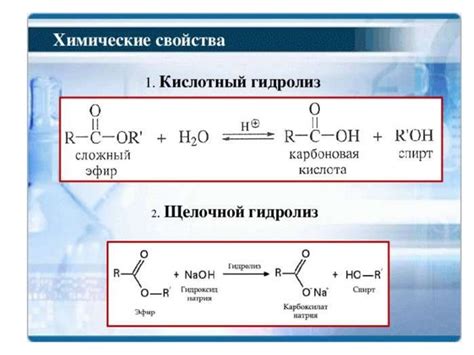
Гидролиз также играет важную роль в реакциях эстерификации и амида. При взаимодействии эстера с водой происходит гидролиз, в результате чего образуется соответствующий кислота и спирт. Аналогично, амиды вступают в реакцию с водой и претерпевают гидролиз, образуя соответствующую карбоновую кислоту и амин.
Гидролиз – это важный процесс, который исполняет множество функций в химии. Знание гидролитических реакций позволяет понять механизмы протекания химических реакций и использовать их в практике для синтеза новых соединений.
Влияние факторов на гидролиз
| Фактор | Влияние на гидролиз |
|---|---|
| Концентрация раствора | Чем выше концентрация раствора хлорида меди, тем быстрее происходит гидролиз. Это связано с увеличением количества активных молекул в реакционной смеси и увеличением столкновений с водой. |
| Температура | Повышение температуры обычно увеличивает скорость гидролиза. Это происходит из-за возрастания скорости химических реакций при повышении температуры и увеличения энергии активации. |
| Кислотность раствора | Гидролиз хлорида меди осуществляется в водных растворах, поэтому изменение кислотности раствора может значительно влиять на скорость гидролиза. Базичность раствора будет способствовать ускорению гидролиза, тогда как кислотность может замедлить процесс. |
Эти факторы влияют на процесс гидролиза хлорида меди, определяя его скорость и эффективность. Понимание влияния этих факторов позволяет контролировать и оптимизировать гидролиз для получения желаемых продуктов и свойств.
Физические свойства гидролитических продуктов

Гидролиз хлорида меди приводит к образованию гидроксида меди (II) и соляной кислоты. Физические свойства этих продуктов различаются.
Гидроксид меди (II) представляет собой зеленовато-голубой аморфный порошок. Он слабо растворим в воде и образует гидроксокомплексы в щелочной среде. Гидроксид меди (II) обладает амфотерными свойствами и может реагировать с кислотами и щелочами.
Соляная кислота – бесцветная жидкость с характерным запахом. Она образуется в результате гидролиза хлорида меди. Соляная кислота является сильным кислотным растворителем и реагирует с множеством веществ. Она реагирует с металлами, оксидами и щелочами, образуя соли и воду.