Железо (Fe) – один из самых распространенных химических элементов в земной коре. Его атом имеет 26 электронов, из которых два находятся в 1s-оболочке, восемь – в 2s-оболочке, 14 – в 2p-оболочке и два – в 3s-оболочке. Валентность, или способность атома образовывать химические связи, определяется числом электронов во внешней электронной оболочке.
У атома железа внешняя электронная оболочка представлена 3s- и 3p-оболочками, на которых находятся в сумме 8 электронов. Однако, железо может образовывать соединения с разными веществами и проявлять две валентности – 2 и 3.
Железо в валентности +2 имеет две незанятые электронами позиции в 3d-оболочке, благодаря чему химически соединяется с веществами, имеющими двойную отрицательную зарядку (соединения Fe(II)). Это объясняет его способность к реакциям окисления-восстановления и участие в электрохимических процессах.
Железо в валентности +3 характеризуется третьим незанятым электронным местом в 3d-оболочке, что позволяет ему участвовать в реакциях и образовывать химические соединения с ионами трехкратной отрицательной зарядкой (соединения Fe(III)). Способность принимать и передавать электроны делает железо также важным участником биохимических процессов в организмах живых существ.
Исторические причины
В древней Греции и Риме железо использовалось для производства оружия, инструментов и различных изделий. Они открыли, что железо может образовывать соединения с разным количеством атомов других элементов.
В процессе исследования свойств железа ученые обнаружили, что оно может иметь две основные валентности - 2 и 3. Валентность 2 означает, что железо может образовывать соединения, в которых на один атом железа приходится два атома другого элемента. Валентность 3 означает, что на один атом железа приходится три атома другого элемента.
Исторические открытия и исследования валентности железа оказали большое влияние на развитие науки и технологий. Сейчас валентность железа 2 и 3 широко используется в различных областях, таких как химия, металлургия, медицина и электроника.
Структурные особенности
В комплексных соединениях железо может иметь валентность 2+ или 3+. Изменение валентности железа обусловлено изменением его электронной конфигурации и переходом электронов между энергетическими уровнями.
Валентность железа 2+ обусловлена наличием двух электронов в свободной оболочке, которые могут участвовать в химических реакциях. Валентность 3+ связана с отсутствием этих электронов в свободной оболочке и потерей трех электронов при взаимодействии с другими элементами.
Структурные особенности атомов и их способность вступать в химические реакции с другими атомами определяют валентность железа и возможность образования соединений с различными валентностями.
Химические свойства

Железо имеет широкий спектр химической активности, что обуславливает его значительную роль в различных химических процессах. Однако, его химические свойства во многом зависят от валентности.
Железо со валентностью 2 (Fe2+) обладает свойством образовывать стабильные соединения с отрицательными ионообразующими элементами, такими как кислород, сера, фтор и др. В это число входят соли железа(II), такие как сульфат железа(II), хлорид железа(II) и многие другие. Железо в этой валентности обладает также окраской палево-зеленого оттенка.
Железо со валентностью 3 (Fe3+) также имеет широкий спектр химической активности. Железо(III) обладает способностью образовывать комплексные соединения с различными лигандами, такими как аммиак, этилендиамин, гидроксиды и многими другими. Кроме того, соединения железа(III) являются сильными окислителями и могут взаимодействовать с различными редуцирующими агентами.
Валентность железа в данном случае влияет на его химическую активность, способность к связыванию ионов и распределению электронного заряда в молекуле или соединении. Именно поэтому валентность железа 2 и 3 являются основными и наиболее распространенными в химических соединениях с участием железа.
| Валентность | Химические свойства |
|---|---|
| Fe2+ | Образование стабильных соединений с отрицательными ионообразующими элементами, окраска палево-зеленого цвета |
| Fe3+ | Образование комплексных соединений, сильная окислительная активность |
Воздействие окружающей среды

Например, в атмосфере кислород окисляет железо, превращая его в ржавчину – оксид железа (III), при этом валентность железа составляет 3. В противовес, в некоторых реакциях железо может быть восстановлено, при этом его валентность становится равной 2.
Также окружающая среда может содержать другие химические вещества, влияющие на валентность железа. Например, в некоторых органических соединениях, таких как ферроцен, железо имеет валентность 2.
Кроме того, валентность железа может изменяться в зависимости от температуры и давления. Например, при высоких температурах и давлениях железо может иметь валентность 3, а при низких – 2.
Роль в биологических системах
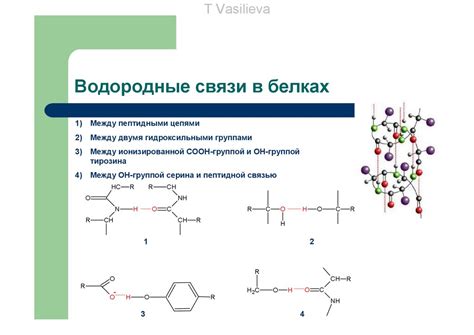
Железо играет ключевую роль в процессе транспорта кислорода в организмах. Оно является существенной составляющей гемоглобина - белка, который связывает кислород и переносит его к тканям и клеткам организма. Кроме того, железо участвует в процессе дыхания и образования энергии в клетках.
Железо также является необходимым для биосинтеза ДНК, РНК и белков, которые являются основными молекулами, отвечающими за передачу и хранение генетической информации, а также регулируют многие биологические процессы в клетках.
В животных железо играет важную роль в иммунной системе. Оно участвует в образовании белых кровяных клеток, которые отвечают за борьбу с инфекциями и болезнями. Также железо способствует укреплению иммунной системы и повышению ее эффективности.
Железо необходимо для правильного функционирования многих ферментов и реакций в организме. Оно участвует в окислительно-восстановительных процессах, а также в процессах обмена веществ и детоксикации.
| Функции железа в биологических системах: |
|---|
| Транспорт кислорода |
| Участие в дыхании и энергетических процессах |
| Биосинтез ДНК, РНК и белков |
| Укрепление иммунной системы |
| Участие в образовании ферментов |
| Участие в окислительно-восстановительных и обменных процессах |