Идеальный газ - это модель, которая предполагает, что межатомные взаимодействия, такие как притяжение и отталкивание, не существуют в газовой среде. Различные законы идеального газа были разработаны для описания поведения такой модели. Однако, существует важный вопрос, связанный с поведением насыщенных паров: насколько они подчиняются законам идеального газа?
Первым законом идеального газа является закон Бойля-Мариотта, который устанавливает обратную пропорциональность между давлением и объемом газа при постоянной температуре. Однако, насыщенные пары существуют при определенной температуре и давлении, когда происходит равновесие между жидкостью и паром. В этом случае, давление насыщенного пара не зависит только от объема и температуры, но также от количества жидкости, которая еще не испарилась.
Второй закон идеального газа, закон Гей-Люссака, устанавливает прямую пропорциональность между давлением и температурой при постоянном объеме газа. Однако, насыщенные пары существуют при постоянной температуре, при которой происходит равновесие между жидкостью и паром. В этом случае, изменение давления насыщенного пара может привести к изменению температуры равновесия между паром и жидкостью.
Таким образом, можно сказать, что насыщенные пары не полностью подчиняются законам идеального газа. Вместо этого, поведение насыщенных паров описывается более сложными моделями, такими как уравнение Клапейрона-Клаузиуса. Это уравнение учитывает изменения давления и температуры в насыщенном паре и позволяет более точно описать его поведение.
Действуют ли законы идеального газа на насыщенные пары?

При нормальных условиях идеальный газ описывается законами Бойля-Мариотта, Шарля, Гая-Люссака и уравнением состояния идеального газа. Однако, применение этих законов к насыщенным парам может быть неточным и требует корректировки.
При повышении давления насыщенного пара происходит конденсация, то есть переход пара обратно в жидкую фазу. В этом случае идеальный газ перестает быть идеальным, так как частицы начинают взаимодействовать с жидкостью и соответствующие силы притяжения становятся значительными.
При низких давлениях и высоких температурах насыщенные пары могут приближаться к поведению идеального газа, так как межмолекулярные взаимодействия становятся меньше влиять на их свойства. Однако, даже в этом случае учитывается наличие молекулярных взаимодействий и необходимость использования корректирующих коэффициентов или модифицированного уравнения состояния.
Обзор понятия насыщенных пар
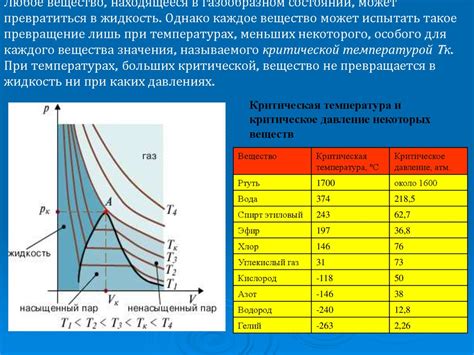
Для идеального газа законы газовой реакции могут быть использованы для описания насыщенных пар. Однако в реальности насыщенные пары часто не подчиняются идеальному газу. В своих свойствах они могут сильно отличаться от идеальных газов.
Свойства насыщенной пары зависят от множества факторов, таких как химический состав жидкости или твердого вещества, температура и давление. Для разных веществ и условий существуют таблицы и диаграммы, которые позволяют определить свойства насыщенной пары, такие как плотность, вязкость, теплопроводность и другие.
Для определения свойств насыщенных пар используется также понятие состояния насыщенной пары. Состояние насыщенной пары определяется точкой на фазовой диаграмме, где жидкость и пар находятся в равновесии. В состоянии насыщенной пары давление и температура являются независимыми переменными.
Важно отметить, что законы идеального газа могут быть применены для насыщенных пар только в приближении. Для более точного описания свойств насыщенных пар необходимо использовать более сложные математические модели и уравнения состояния.
| Свойства | Зависимость от факторов |
|---|---|
| Плотность | Химический состав, температура, давление |
| Вязкость | Химический состав, температура, давление |
| Теплопроводность | Химический состав, температура, давление |
Подчиняются ли насыщенные пары законам идеального газа?

Под идеальным газом понимают систему, состоящую из молекул, которые взаимодействуют друг с другом или с окружающей средой только при столкновениях, а притяжением и отталкиванием молекул между собой система пренебрегает. Это теоретическая модель, которая может быть применена для описания многих газовых смесей и паров.
Переход из жидкого состояния в газообразное называется испарением или выпариванием. Насыщенным паром называется пар, который находится в равновесии с жидким веществом при данной температуре и давлении. Температура, при которой давление насыщенного пара равно давлению насыщенного пара при жидкости, называется температурой кипения. Насыщенные пары обладают некоторыми свойствами и характеристиками, которые могут описываться законами идеального газа.
Законы идеального газа включают закон Бойля, закон Шарля и закон Гей-Люссака. Закон Бойля утверждает, что при постоянной температуре идеальный газ обратно пропорционален его давлению. Закон Шарля устанавливает, что при постоянном давлении объем идеального газа прямо пропорционален его температуре в абсолютной шкале. Закон Гей-Люссака утверждает, что при постоянном объеме идеальный газ прямо пропорционален его температуре в абсолютной шкале.
Однако, в отличие от идеальных газов, насыщенные пары обычно не полностью подчиняются этим законам. Это связано с тем, что взаимодействие между молекулами насыщенного пара может быть значительным, особенно при низких температурах и высоких давлениях.
Тем не менее, при определенных условиях, насыщенные пары могут приближаться к идеальному поведению. Например, при достаточно высоких температурах и низких давлениях молекулы насыщенного пара могут обладать высокой кинетической энергией и их взаимодействие может стать пренебрежимо малым.
В целом, подчинение насыщенных паров законам идеального газа зависит от условий, при которых они находятся. Конкретные свойства и характеристики паров будут отличаться в зависимости от вещества, его температуры и давления. Поэтому при рассмотрении поведения паров необходимо учитывать их особенности и применять соответствующие модели и законы для их описания.
Доказательства согласованности законов идеального газа для насыщенных пар

1. Закон Бойля-Мариотта
Закон Бойля-Мариотта утверждает, что при постоянной температуре объем газа обратно пропорционален давлению, то есть:
P₁V₁ = P₂V₂
Для насыщенной пары это также справедливо. Например, если увеличить давление дыма в комнате с насыщенной парой, то давление пары также увеличится пропорционально, чтобы сохранить равновесие.
2. Закон Шарля
Закон Шарля утверждает, что объем газа при постоянном давлении прямо пропорционален его температуре, то есть:
V₁/T₁ = V₂/T₂
Для насыщенной пары это также верно. При повышении температуры пары, ее объем будет увеличиваться пропорционально, чтобы поддерживать равновесие.
3. Формула Клапейрона
Формула Клапейрона представляет собой обобщение закона Бойля-Мариотта и закона Шарля. Она утверждает, что для идеального газа справедливо следующее уравнение:
PV = nRT
где P - давление газа, V - его объем, n - количество вещества газа, R - универсальная газовая постоянная, T - температура газа.
Это уравнение также верно для насыщенной пары. Количество вещества газа в паре остается постоянным, поэтому изменения давления, объема и температуры будут связаны в соответствии с этим уравнением.
Таким образом, законы идеального газа справедливы и для насыщенных пар. Они описывают изменения давления, объема и температуры пары в соответствии с определенными математическими отношениями, что подтверждает их согласованность.