Перекись водорода – это химическое соединение, состоящее из двух атомов водорода и двух атомов кислорода. Она обладает уникальными свойствами, которые делают ее одним из важнейших веществ в биохимических и физиологических процессах организма. Хотя перекись водорода является нестабильным соединением, она играет ключевую роль в реакциях окисления и восстановления, а также в протекании многих других биологических процессов.
Распад перекиси водорода имеет несколько различных механизмов. Один из них – автоокисление. В этом процессе перекись водорода распадается сама по себе под воздействием высоких температур или с помощью катализаторов, таких как металлы или ферменты. Второй механизм – фотоокисление. Перекись водорода может распадаться под воздействием света различных длин волн, особенно ультрафиолетового излучения.
Ионизация перекиси водорода – это процесс, при котором перекись водорода теряет один или несколько электронов и образует положительный ион. Этот процесс может быть вызван воздействием различных физических факторов, таких как электрическое поле или электромагнитные волны. Ионизированная перекись водорода обладает повышенной активностью и может участвовать во многих химических реакциях, включая окислительные процессы и реакции с металлами.
Механизмы распада и ионизации перекиси водорода

Автокаталитический механизм распада перекиси водорода основан на реакции самопроизвольного распада, когда перекись распадается на воду (H2O) и кислород (O2). Этот процесс часто ускоряется наличием катализаторов, таких как металлы (например, железо или марганец) или ферроцен.
Ферментативный механизм распада перекиси водорода связан с действием ферментов, таких как пероксидазы и каталазы. Пероксидазы катализируют перевод гидрогенпероксида в галогенопероксиды и воду, в то время как каталаза превращает его в воду и молекулярный кислород. Эти ферменты обычно находятся в организмах живых организмов и играют важную роль в защите от окислительного стресса.
Ионизация перекиси водорода может происходить в присутствии водных растворов, образуя гидроксидные и пероксидные ионы. Пероксидные ионы (HOO-) играют важную роль в биохимических процессах и являются активными радикалами, способными вызывать окислительное повреждение клеток.
В целом, механизмы распада и ионизации перекиси водорода представляют сложные физические процессы, которые требуют дополнительных исследований для полного понимания их ключевых особенностей и возможных применений.
Суть процессов
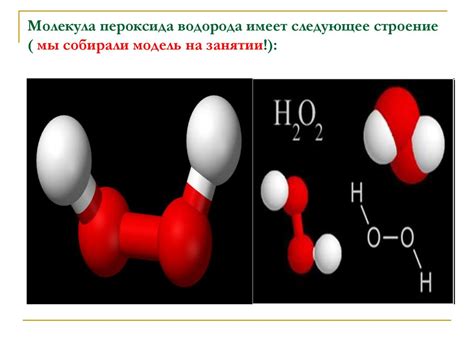
Механизмы распада и ионизации перекиси водорода представляют собой физические процессы, в основе которых лежит свойство молекулы H2O2 разлагаться на воду (H2O) и кислород (O2).
При распаде перекиси водорода происходит разрушение связей между атомами водорода и кислорода. Этот процесс сопровождается высвобождением энергии, которая может быть использована в различных химических реакциях. Данный процесс может происходить самопроизвольно или под воздействием факторов, таких как тепло, свет или катализаторы.
Ионизация перекиси водорода – это процесс, в результате которого молекула H2O2 теряет один или несколько электронов, превращаясь в ионы. Полученные ионы, в свою очередь, могут участвовать в различных химических реакциях. Ионизация может происходить как под воздействием внешних факторов, таких как температура или электрическое поле, так и при контакте с другими веществами.
Понимание сути этих процессов имеет большое значение в различных областях науки и техники. Изучение механизмов распада и ионизации перекиси водорода позволяет разрабатывать новые методы синтеза и разделения веществ, применять перекись водорода в медицине и промышленности. Кроме того, эти процессы широко используются в аналитической химии для определения содержания перекиси водорода в различных веществах.
Физические особенности:
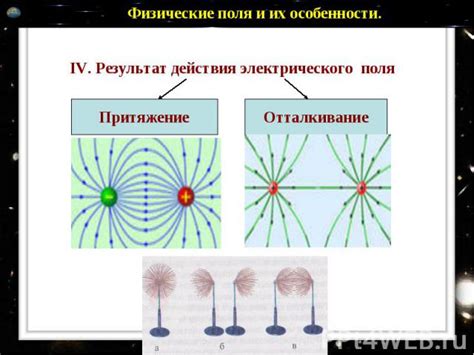
Ионизация перекиси водорода происходит взаимодействием с электромагнитным излучением или другими частицами. Это происходит благодаря наличию свободных радикальных групп, которые реагируют с внешними воздействиями. В результате ионизации, перекись водорода претерпевает изменения в газообразном состоянии.
Важно отметить, что распад и ионизация перекиси водорода являются обратимыми процессами, что означает, что перекись водорода может снова образоваться из продуктов ее распада или ионизации. Поэтому, для более детального изучения указанных процессов требуется учет не только факторов, но и физических условий, в которых они происходят.
Тепловая диссоциация перекиси водорода
Н2О2 → 2НО + O2
В ходе данной реакции молекула перекиси водорода распадается на две молекулы оксида водорода и молекулу кислорода. Этот процесс сопровождается поглощением тепла.
Тепловая диссоциация перекиси водорода может быть инициирована различными способами, включая повышение температуры, воздействие света или катализаторов. Однако, без наличия внешней энергии большинство молекул перекиси водорода остаются стабильными и не распадаются.
Тепловая диссоциация перекиси водорода играет важную роль во многих физических и химических процессах. В частности, она является ключевым этапом восстановления озона в стратосфере и участвует в некоторых реакциях горения. Кроме того, данная реакция может использоваться в промышленности для получения оксида водорода и кислорода.
Важно отметить, что тепловая диссоциация перекиси водорода является комплексным процессом, который зависит от ряда факторов, включая температуру, давление, концентрацию перекиси водорода и наличие катализаторов. Более глубокое изучение данного механизма распада позволит расширить наши знания в области химии и физики и применить его в различных областях науки и промышленности.
Фотолиз перекиси водорода

Фотолиз перекиси водорода может происходить при наличии достаточно энергичного фотона, который способен разрушить связь между атомами водорода и кислорода. Основным механизмом фотолиза является абсорбция фотона молекулой перекиси водорода, что приводит к возбуждению электронов валентной оболочки.
После абсорбции фотона, возбужденные электроны могут претерпевать серию переходов между энергетическими уровнями и, в конечном итоге, могут вызывать распад молекулы перекиси водорода на два радикала - гидроксильный (ОН) и гидроксидный (О).
Реакции фотолиза перекиси водорода могут происходить как в газовой фазе, так и в растворе. Они часто используются в различных приложениях, таких как очистка воды и стерилизация, а также в фотохимических процессах, связанных с производством энергии.
Понимание механизмов фотолиза перекиси водорода является важной задачей в химии и физике, поскольку позволяет разрабатывать более эффективные методы использования перекиси водорода в различных технологических процессах.
Роль катализаторов
Катализаторы играют важную роль в процессах распада и ионизации перекиси водорода, так как они снижают активационную энергию реакций, позволяя им протекать при более низких температурах и с большей скоростью.
Роль катализаторов заключается в том, что они обладают поверхностью, на которой происходит взаимодействие перекиси водорода и других молекул. Это способствует образованию активных центров реакции и облегчает процессы диссоциации и ионизации.
Катализаторы могут быть различных типов и содержать различные элементы, такие как металлы или их соединения. Они также могут обладать определенной структурой и формой, что также оказывает влияние на эффективность их действия.
Использование катализаторов позволяет улучшить эффективность процессов распада и ионизации перекиси водорода, что имеет важное практическое применение. Например, это может быть использовано в процессах очистки воды, в производстве химических веществ или в использовании водорода в качестве энергетического источника.
Практическое применение

Изучение механизмов распада и ионизации перекиси водорода имеет значительное практическое значение в различных областях науки и технологий.
Одним из примеров применения перекиси водорода является ее использование в качестве окислителя в ракетной технике. Благодаря своим химическим свойствам, перекись водорода может быть использована в ракетных двигателях для создания большого количества газового потока при сгорании с топливом. Это позволяет достичь высокой тяги и повысить эффективность ракетного двигателя.
Перекись водорода также применяется в качестве окислителя в промышленности для различных процессов окисления. Например, она используется в химическом производстве, в процессе очистки воды и сточных вод, а также в процессах биотехнологии и фармацевтической промышленности.
Еще одним применением перекиси водорода является ее использование в медицине. Она используется для дезинфекции и обработки контактных линз, а также в процедурах отбеливания зубов.
Кроме того, перекись водорода может быть использована в экологически чистых источниках энергии. Например, она может быть использована в горючих элементах, которые генерируют электричество при реакции окисления перекиси водорода с катодным материалом.
Все это демонстрирует широкий спектр практических применений перекиси водорода и значимость изучения ее механизмов распада и ионизации для развития новых технологий и научных открытий.