Оксиды - это класс химических соединений, состоящих из кислорода и одного или более других элементов. Они играют важную роль во многих процессах и реакциях в природе и промышленности.
Но как же найти формулу оксида для конкретного элемента?
Существует несколько способов поиска формулы оксида для различных элементов. Один из наиболее распространенных способов - использование таблицы Менделеева, где различные элементы отображены в порядке возрастания их атомного номера.
В таблице Менделеева вы можете найти элемент, для которого хотите найти формулу оксида, и посмотреть на его номер, расположенный над символом элемента. Например, для кислорода атомный номер равен 8.
Следующим шагом является определение заряда оксида. Заряд оксида связан с его химическим составом и может быть определен на основе правил назначения зарядов. Например, заряд оксида кислорода всегда равен -2. Зная заряд оксида и заряд элемента, вы можете составить формулу оксида, уравновешивая заряды элемента и оксида.
Что такое оксид в химии и как найти его формулу?
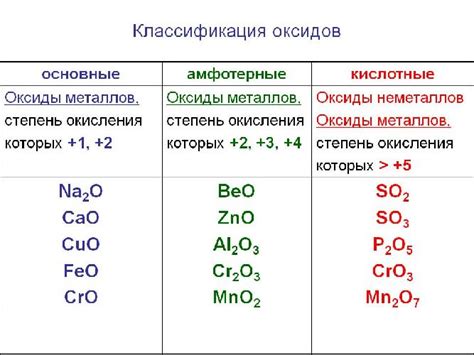
Чтобы найти формулу оксида, необходимо знать атомные номера и заряды элементов, входящих в соединение. Заряд кислорода обычно равен -2, за исключением нескольких особых случаев. Заряд другого элемента можно найти в таблице периодических элементов или известным способом.
Для определения формулы оксида используйте правило взаимной компенсации зарядов. Заряд оксида будет равен сумме зарядов элементов в соединении. Например, если кислород имеет заряд -2, а второй элемент имеет заряд +3, формула оксида будет О2X3.
Если заряд элемента положительный, но не делится нацело на 2, необходимо найти наименьшее общее кратное между модулем заряда этого элемента и 2. Затем измени заряд кислорода так, чтобы общее кратное совпадало с модулем заряда элемента. Например, если заряд элемента равен +4, а кислорода равен -2, формула оксида будет ОX2.
Используя эти простые правила и таблицу периодических элементов, вы можете легко найти формулу оксида в химии. Учтите, что некоторые оксиды могут иметь сложные формулы, такие как Fe3O4 или P4O10, но эти правила останутся действительными и в этих случаях.
Как определить оксид в химическом соединении
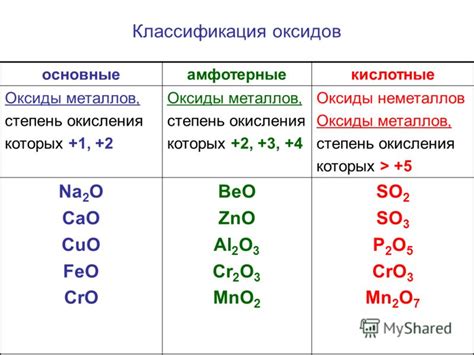
Определить наличие оксида в химическом соединении может быть несколько способов.
1. Анализ формулы. Оксиды обычно имеют формулу, в которой атом кислорода указывается перед атомом другого элемента. Например, оксид алюминия имеет формулу Al2O3, где два атома алюминия связаны с тремя атомами кислорода.
2. Наименование соединения. Оксиды обычно имеют в своем названии слово "оксид". Например, оксид углерода (CO), оксид кальция (CaO).
3. Физические свойства. Оксиды, как правило, образуют твердые вещества, но некоторые могут быть газообразными или жидкими при стандартных условиях. Они также обладают характеристиками, характерными для оксидов, такими как высокая температура плавления или кипения.
4. Химические свойства. Оксиды могут образовывать кислоты или щелочи при реакции с водой. Они также могут быть окислителями или восстановителями в химических реакциях.
Используя эти способы, вы сможете определить наличие оксида в химическом соединении и получить более полное понимание его свойств и реакционной активности.
Оксиды и их свойства
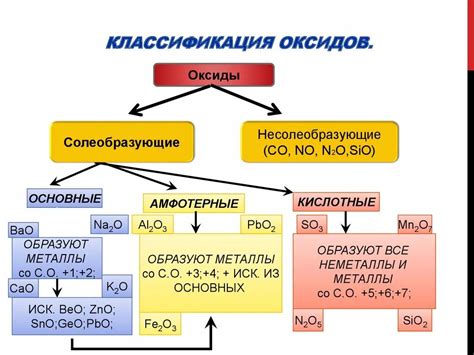
У оксидов есть несколько общих свойств:
- Химическая стабильность: Оксиды обладают высокой степенью химической стабильности, что делает их долговечными и устойчивыми к различным реакциям.
- Физические свойства: Оксиды обычно являются твердыми веществами, но некоторые из них могут быть газообразными или жидкими при определенных условиях.
- Кислотность или основность: Оксиды могут быть кислотными, основными или амфотерными в зависимости от их реакции с водой.
- Электрохимическое поведение: Оксиды могут быть электрохимически активными и использоваться в электрохимических процессах, таких как электролиз и гальваническая коррозия.
Оксиды широко используются в различных промышленных отраслях, таких как производство стали, строительство материалов, электроника и многое другое. Они также играют важную роль в экологической химии и исследованиях в области снижения выбросов и очистки загрязненной воды и воздуха.
Понимание свойств и применения оксидов является ключевым аспектом в изучении химии. Разнообразие и широта этой группы соединений делает их увлекательными для исследования и практического применения в различных областях науки и промышленности.
Почему формула оксида важна для химика
Формула оксида обычно состоит из двух элементов - кислорода и другого элемента, который может быть металлом или неметаллом. Количество атомов кислорода и другого элемента в формуле определяет тип оксида и его стехиометрию. Это позволяет классифицировать оксид как оксид металла или неметалла и определить его химическую активность и реакционную способность.
Формула оксида также может указывать на состояние оксида - это может быть газообразное, жидкое или твердое вещество. Эти указания помогают химику в выборе правильных условий для проведения реакций и определении физических свойств оксида.
Кроме того, формула оксида может давать информацию о молекулярной или ионной структуре соединения и его кристаллической решетке. Это важно для понимания особенностей взаимодействия оксида с другими химическими веществами и его ролью в различных химических процессах.
Все эти аспекты делают формулу оксида неотъемлемой частью химического анализа и исследования соединений. Знание формулы оксида позволяет химику предсказывать его химические и физические свойства, рассчитывать количество вещества в реакции и проводить более эффективные опыты.
Основные правила составления формулы оксида

Вот основные правила, которые следует учитывать при составлении формул оксидов:
- Название оксида обычно состоит из названия элемента и суффикса "-оксид", например, оксид алюминия (Al2O3).
- Учитывайте, что основным оксидом называются оксиды, которые реагируют с водой, образуя основания. Они обычно имеют формулы, включающие гидроксильную группу (OH), как, например, оксид кальция (CaO) - главный компонент извести.
- Оксиды не металлов обычно образуются путем соединения кислорода с неметаллическими элементами. Единица кислорода в этих соединениях обычно равна двум, поэтому для получения формулы оксида нужно установить валентность неметалла, которая обозначает число, указывающее на способность атома неметалла принимать или отдавать электроны. Например, оксид серы (SO2) - это соединение серы с кислородом, где сера имеет валентность 4.
- Ионные оксиды, или оксиды металлов, формируются путем соединения кислорода с металлом. В этих соединениях кислород обычно имеет валентность -2. Например, оксид натрия (Na2O) - это соединение натрия с кислородом, где каждый атом кислорода имеет валентность -2.
- Для оксидов металлов с переменной валентностью используются римские цифры, чтобы указать степень окисления металла. Например, оксид железа(II) (FeO) и оксид железа(III) (Fe2O3) - это оксиды железа с разными степенями окисления.
Знание основных правил составления формул оксидов позволяет определить их состав и степень окисления элементов. Это важно при изучении различных химических реакций и свойств оксидов.
Примеры формул оксидов в химии
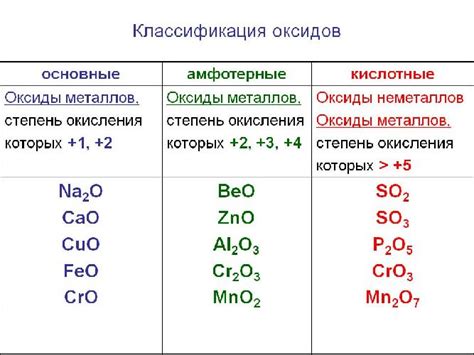
Вот некоторые примеры формул оксидов:
- Оксид углерода (IV) – СО2
- Оксид азота (IV) – NO2
- Оксид серы (VI) – SO3
- Оксид алюминия – Al2O3
- Оксид железа (III) – Fe2O3
- Оксид кальция – CaO
Эти примеры показывают разнообразие формул оксидов и их различные химические свойства. Оксиды играют важную роль в жизни человека, например, в процессе сгорания топлива или в производстве цемента. Изучение оксидов в химии полезно для понимания различных химических процессов и для разработки новых материалов и технологий.
Методы исследования оксидов и их формул
Существует несколько методов исследования оксидов и определения их формул. Некоторые из них включают:
- Спектроскопия: этот метод использует спектральный анализ для измерения поглощения и испускания света оксидами. Это позволяет определить концентрацию элементов, входящих в состав оксидов, и проанализировать их электронную структуру.
- Масс-спектрометрия: этот метод использует масс-спектрометр для определения массы и состава молекул оксидов. Он позволяет идентифицировать различные изотопы элементов, присутствующих в оксидах, и рассчитать их относительное содержание.
- Хроматография: данная техника используется для разделения и анализа различных компонентов оксидов. Она основана на различной скорости переноса веществ через стационарную и подвижную фазы.
- Рентгеноструктурный анализ: этот метод использует рентгеновское излучение для определения трехмерной структуры оксидов. Он позволяет определить положения атомов в оксидной решетке и оценить длины и углы связей между ними.
Каждый из этих методов имеет свои преимущества и ограничения, и наиболее эффективный метод выбирается в зависимости от цели исследования. Использование современных инструментальных методов анализа позволяет с большой точностью определить формулы оксидов и получить более глубокое представление о их структуре и свойствах.
Практические рекомендации по поиску формулы оксида

Поиск формулы оксида может быть сложной задачей, особенно для новичков в химии. Для упрощения этого процесса, следуйте приведенным ниже практическим рекомендациям:
1. Изучите характеристики элемента или группы элементов, для которых вы ищете формулу оксида. Они могут быть металлическими или неметаллическими, а также иметь различные степени окисления.
2. Определите валентность элемента или группы элементов. Валентность указывает на количество электронов, которые элемент может отдать или принять во время образования химической связи.
3. Установите соотношение между элементом или группой элементов и кислородом. Это позволит определить количество атомов кислорода, с которым будет связан элемент или группа элементов.
4. Используйте понятие заполнения энергетических уровней атома для определения степени окисления элемента или группы элементов. Степень окисления обычно указывает на присутствие положительных или отрицательных зарядов у элемента или группы элементов.
5. Для определения формулы оксида, учитывайте электронную структуру элемента или группы элементов, а также количество атомов кислорода, с которым будет связан элемент или группа элементов. Обычно оксид содержит один атом кислорода.
Пример:
| Элемент | Валентность | Степень окисления | Формула оксида |
|---|---|---|---|
| Магний (Mg) | +2 | +2 | MgO |
| Алюминий (Al) | +3 | +3 | Al2O3 |
| Серебро (Ag) | +1 | +1 | Ag2O |
| Хлор (Cl) | -1 | -1 | Cl2O |
Следуя этим практическим рекомендациям, вы сможете успешно найти формулу оксида для различных элементов или групп элементов. При необходимости, используйте таблицу Менделеева и другие онлайн-ресурсы для получения дополнительной информации.
Роли оксидов в природе и промышленности

Оксиды, химические соединения, состоящие из кислорода и других элементов, играют важную роль как в природе, так и в промышленности.
В природе оксиды присутствуют повсеместно и выполняют различные функции. Один из самых известных оксидов – оксид кремния, или кварц – является основным составляющим минерала в земной коре. Функция оксида кремния заключается в его прочности и стабильности, а также в его способности образовывать стекло и керамику.
Другой важный оксид в природе – оксид железа, который представлен несколькими различными формами, такими как гематит и магнетит. Оксид железа является основным источником железа для производства стали и других металлов. Оксид железа также имеет важное значение в биологических системах, так как является частью гемоглобина, переносящего кислород в организмах.
В промышленности оксиды широко используются в различных областях. Например, оксид алюминия, или алюминий оксид, используется в производстве керамики, абразивов, алюминиевого металла и других продуктов. Кроме того, оксид меди используется в производстве электродов, электроники и других изделий из меди.
Таким образом, оксиды играют важную роль в различных сферах нашей жизни, начиная от природных процессов до промышленных процессов. Изучение и использование оксидов является важной задачей в химии и материаловедении.