Растворение соли в воде – процесс, который знаком каждому школьнику еще со школьной скамьи. Благодаря этому явлению соль выполняет одну из ключевых ролей в нашей жизни. Но что же происходит на молекулярном уровне, когда соль погружается в воду? Почему она так быстро и полностью растворяется? Давайте разберемся вместе.
Соль, на самом деле, состоит из множества молекул. Каждая молекула соли представляет собой совокупность двух ионов: положительного натрия и отрицательного хлора. Именно эти ионы обеспечивают специфический вкус соли и ее способность растворяться в воде.
Когда соль попадает в воду, молекулы воды начинают образовывать вокруг ионов соли оболочки гидратации. Эта оболочка состоит из молекул воды, которые охватывают ионы соли с помощью сильных химических связей. Таким образом, образуется гидратированный ион, готовый к перемещению по раствору.
Именно благодаря этому механизму гидратации соль так быстро растворяется в воде. Молекулы воды разрушают силы притяжения между ионами соли и позволяют им свободно перемещаться по раствору. Это объясняет, почему соль растворяется так полностью, не оставляя видимых остатков.
Причины полного растворения соли в воде
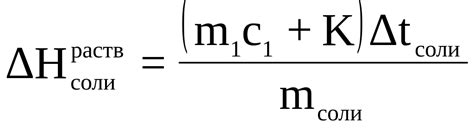
Одной из основных причин, по которой соль полностью растворяется в воде, является ее полярность. Вода является полярным растворителем, то есть молекулы воды имеют положительные и отрицательные заряды. Молекулы соли, в свою очередь, также имеют положительные и отрицательные ионы.
Вода притягивает ионы соли силой притяжения, известной как ионно-дипольное взаимодействие. Поскольку эта сила притяжения сильнее силы, удерживающей ионы соли в кристаллической решетке, ионы начинают отрываться от кристалла соли и перемещаются в раствор.
Процесс растворения соли в воде происходит последовательно и включает в себя три основных этапа:
1. Диссоциация соли. Когда соль попадает в воду, молекулы воды разлагают ее на положительные и отрицательные ионы, которые затем окружаются молекулами воды.
2. Гидратация ионов. В течение этого этапа ионы соли окружаются слоями молекул воды, образуя гидратированные ионы. Это происходит благодаря электростатическим силам притяжения между ионами соли и полярными молекулами воды.
3. Диффузия и дисперсия ионов. В конечном итоге, гидратированные ионы диффундируют по раствору, перемещаясь от области более высокой концентрации к области более низкой концентрации. Таким образом, соль полностью растворяется в воде.
Однако стоит отметить, что не все соли полностью растворяются в воде. Некоторые соли, такие как гидроксиды металлов и карбонаты, образуют осадок при растворении в воде, так как ионы этих солей образуют инсолюбильные соединения с водой.
Физические и химические свойства соли

Сама соль представляет собой кристаллическую структуру, состоящую из ионов натрия (Na+) и хлора (Cl-). Она обладает прочной решеткой, что делает ее твердым веществом при комнатной температуре.
Одним из основных физических свойств соли является ее растворимость в воде. Соль полностью растворяется в воде, образуя раствор, в котором ионы Na+ и Cl- разбросаны по всему объему раствора. Это свойство позволяет использовать соль в кулинарии, а также в различных промышленных процессах.
Химические свойства соли также представляют интерес. Например, когда соль взаимодействует с кислотой, происходит реакция нейтрализации, в результате которой образуется соль и вода. Кроме того, соль может участвовать в многих других химических реакциях, играя роль окислителя или восстановителя.
Соль обладает также рядом других физических свойств, таких как высокая плотность, высокая температура плавления и кипения, а также способность проводить электрический ток в расплавленном или растворенном состоянии. Эти свойства позволяют использовать соль в различных областях, включая химическую промышленность, медицину, пищевую промышленность и др.
В целом, физические и химические свойства соли делают ее одним из наиболее важных веществ, которое широко применяется в нашей повседневной жизни.
Свойства воды, способствующие растворению соли

Во-первых, вода обладает полярной структурой молекулы, в результате чего образуются водородные связи между молекулами. Это способствует электростатическому притяжению молекул соли и облегчает их растворение. Молекулы воды образуют ореол гидратации вокруг ионов соли, что устраняет электростатическую притяжение между положительно и отрицательно заряженными ионами и позволяет им равномерно распределиться в растворе.
Во-вторых, вода обладает высоким диэлектрическим const(permittivity), что означает ее способность слабить электрические поля. Это свойство играет важную роль в растворении соли, поскольку оно позволяет подавить силу притяжения между ионами соли и облегчает их растворение. Благодаря высокому диэлектрическому const(permittivity), ионы соли легче размещаются между молекулами воды, что способствует их равномерному распределению в растворе.
В-третьих, вода обладает высокой растворимостью многих веществ, в том числе солей. Это можно объяснить гидратацией ионов соли молекулами воды. В процессе растворения соль ионизируется, образуя положительно и отрицательно заряженные ионы, которые гидратируются молекулами воды. Эта гидратация способствует диссоциации ионов и способствует более эффективному растворению соли.
Механизмы растворения соли в воде
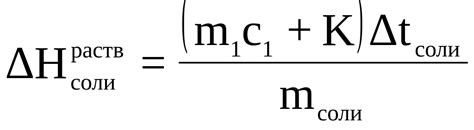
Когда кристалл соли попадает в воду, молекулы воды начинают взаимодействовать с ионами соли. Полярность молекул воды обусловлена наличием заряда на атомах кислорода и водорода. Молекулы воды ориентируются таким образом, что положительный полюс (атом водорода) притягивает отрицательный ион соли (натрий), а отрицательный полюс (атом кислорода) притягивает положительный ион соли (хлор).
Таким образом, происходит процесс гидратации ионов, когда молекулы воды окружают ионы соли и образуют водородные связи с ними. Гидратированные ионы соли, образовавшиеся в результате этого процесса, становятся свободными, окруженными молекулами воды, и их природа уже не является ионной.
Механизм растворения соли в воде также зависит от температуры и концентрации соли. При повышении температуры молекулы воды становятся более подвижными и быстрее взаимодействуют с ионами соли, что повышает скорость растворения. Концентрация соли также оказывает влияние на механизм растворения: при низкой концентрации соли, каждая молекула воды может успешно взаимодействовать с ионами соли, в то время как при высокой концентрации соли может происходить образование кристаллической решетки.
| Преимущества растворения соли в воде: | Недостатки растворения соли в воде: |
|---|---|
| 1. Обеспечение постоянного снабжения организма минеральными элементами | 1. Возможное образование отложений на поверхностях и в трубопроводах |
| 2. Создание и поддержание равновесия внутриклеточного и внеклеточного пространства | 2. Влияние на вкус питьевой воды |
| 3. Участие в жизненно важных процессах организма (нервная система, сердечно-сосудистая система и др.) | 3. Возможное раздражение кожи и слизистых |
Таким образом, растворение соли в воде является сложным процессом, который обусловлен взаимодействием молекул воды с ионами соли и зависит от температуры и концентрации. При правильном балансе соли в воде достигается оптимальное функционирование организма, однако неконтролируемое растворение может иметь негативные последствия.