Молекулы, составляющие все вещества в нашей вселенной, имеют определенную структуру и взаимосвязь между своими атомами. Понимание этих связей и структур является ключевым в изучении природы и свойств вещества. Наука, занимающаяся исследованием этих взаимодействий атомов и молекул, называется химией. Химики стремятся раскрыть все тайны строения вещества и использовать полученные знания для разработки новых материалов и применений.
В основе понимания связей между атомами лежит понятие химической связи. Химическая связь образуется, когда атомы поделили свои внешние электроны с другими атомами, чтобы стабилизировать свою энергетическую конфигурацию. Эти электроны образуют некую "связь" между атомами. Они держат атомы вместе и создают молекульную структуру. Разные типы связей, такие как ковалентная, ионная и металлическая, определяют свойства и поведение различных веществ.
Структура молекулы, в свою очередь, определяет ее форму и функционирование. Правильное расположение атомов и связей внутри молекулы может сделать ее стабильной и активной, обеспечивать физические и химические свойства. Так, например, молекулы, состоящие из тех же элементов, но с разной структурой, могут обладать совершенно разными свойствами. Это объясняет, почему вещества могут быть как твердыми, так и жидкими или газообразными, и почему они имеют различные температуры плавления и кипения.
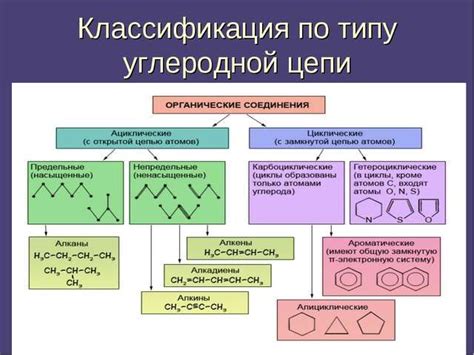
Основы структуры вещества
Атомы, входящие в состав вещества, связаны между собой различными типами химических связей. Существуют ковалентные связи, ионные связи, металлические связи и другие. Каждая из этих связей имеет свои характеристики и влияет на структуру вещества.
Структура вещества может быть аморфной или кристаллической. Аморфные вещества имеют беспорядочное расположение атомов или молекул и не обладают долговременной упорядоченностью. Кристаллические вещества, напротив, имеют регулярную и повторяющуюся структуру, образованную кристаллической решеткой.
Каждое вещество имеет свою уникальную структуру, которая определяется химическим составом и условиями образования. Изучение структуры вещества позволяет понять его физические и химические свойства, а также способствует разработке новых материалов с определенными свойствами.
- Ковалентные связи - это связи, образующиеся при обмене электронами между атомами. Они обладают высокой прочностью и определяют форму и размеры молекулы.
- Ионные связи - это связи, образующиеся между атомами с разными зарядами. Они имеют низкую прочность и определяют кристаллическую структуру вещества.
- Металлические связи - это связи, образующиеся между атомами металла. Они обладают высокой проводимостью электричества и определяют металлические свойства вещества.
Молекулы и их атомы
Атом - это наименьшая единица химического элемента, обладающая его химическими свойствами. В атоме обычно присутствуют протоны, нейтроны и электроны.
Связи между атомами в молекулах могут быть разными: ковалентными, ионными, металлическими и др. Ковалентная связь - это связь, в которой электроны общие для двух атомов. Ионная связь - это связь, в которой атомы образуют положительно и отрицательно заряженные ионы, притягивающиеся друг к другу.
Структура молекулы определяет ее физические и химические свойства. Например, строение органических молекул влияет на их реакционную способность и способность образовывать различные взаимодействия с другими веществами.
Изучение связей между атомами и структур молекул позволяет нам понять, как вещество ведет себя в различных условиях, как оно соединяется с другими веществами и как это влияет на его свойства и реакционную способность. Данная область знаний является ключевой в химическом исследовании и применяется в различных областях науки и промышленности.
Типы связей между атомами
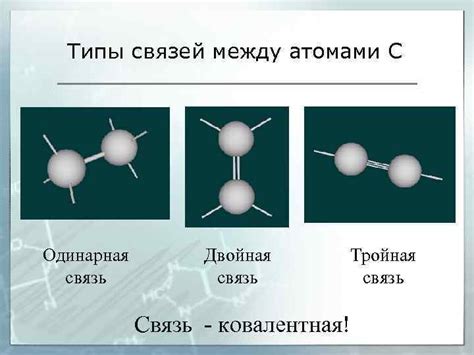
Связи между атомами в молекулах играют ключевую роль в определении их свойств и характеристик. Существует несколько типов связей, которые можно обнаружить в различных молекулах:
| Тип связи | Описание |
|---|---|
| Ковалентная связь | Это наиболее распространенный тип связи, при котором два атома разделяют электроны. Ковалентная связь может быть полярной или неполярной в зависимости от разности электроотрицательности атомов. В неполярной ковалентной связи электроны равномерно распределены между атомами, а в полярной ковалентной связи электроны сдвинуты ближе к одному из атомов. |
| Ионная связь | Ионная связь возникает между атомами с противоположными зарядами. Один атом отдает электроны, становясь положительно заряженным ионом, а другой атом принимает электроны, становясь отрицательно заряженным ионом. Ионная связь характеризуется сильной притяжением этих зарядов. |
| Металлическая связь | Металлическая связь возникает между атомами металла. В этом типе связи внешние электроны металлической решетки делятся между всеми атомами, создавая сеть положительных ионов и облако свободных электронов, которое дает металлам характерные свойства. |
| Водородная связь | Водородная связь возникает между атомом водорода, связанным с электроотрицательным атомом (каким-либо из атомов кислорода, азота или флуора), и другим электроотрицательными атомами. Водородные связи обладают большой прочностью и важны в поддержании структурных свойств белков и нуклеиновых кислот. |
Значение структуры молекул
Связи между атомами в структуре молекул могут быть разного типа: ковалентные, ионные, металлические и другие. Ковалентные связи возникают при совместном использовании пары электронов двумя атомами. Ионные связи формируются между атомами с различным зарядом, когда один атом отдаёт, а другой принимает электрон(ы). Металлические связи характерны для металлов и основаны на наличии свободных электронов.
Структура молекул также определяет их геометрию, т.е. форму и трехмерное расположение атомов в пространстве. Геометрия молекул влияет на такие свойства вещества, как физическая состояние (твердое, жидкое или газообразное), точки плавления и кипения, растворимость и т. д.
| Тип связи | Описание | Примеры |
|---|---|---|
| Ковалентные связи | Образуются при совместном использовании пары электронов двумя атомами. | Связь между атомами кислорода в молекуле воды (H2O). |
| Ионные связи | Формируются между атомами с различным зарядом при передаче электрона(ов). | Связь между ионами кальция (Ca2+) и хлора (Cl-) в молекуле хлорида кальция (CaCl2). |
| Металлические связи | Характерны для металлов и основаны на наличии свободных электронов. | Связи между атомами металла в молекуле железа (Fe). |
Понимание связей и свойств вещества

Связи между атомами в молекуле могут быть ионическими или ковалентными. В ионической связи образуется притяжение между положительно и отрицательно заряженными ионами. Ковалентная связь, напротив, возникает при совместном использовании электронов атомами для образования пары общих электронов. Эти связи между атомами определяют форму и структуру молекулы, а также ее физические и химические свойства.
Более сложные системы вещества, такие как полимеры и кристаллические структуры, также обладают уникальными связями и свойствами. Полимеры состоят из повторяющихся молекул, связанных вдоль цепи, и могут иметь различные физические и химические свойства в зависимости от их структуры. Кристаллические структуры, с другой стороны, имеют регулярную и повторяющуюся симметричную структуру и обычно обладают определенными оптическими и электронными свойствами.
Понимание связей и свойств вещества позволяет химикам разрабатывать новые материалы с желаемыми свойствами и применениями. Например, различные полимеры могут использоваться для создания прочных пластиков, эластичных резиновых изделий или гибких пленок. Знание связей и структур также позволяет предсказывать химические реакции и воздействие веществ на окружающую среду, что важно для безопасности и охраны окружающей среды.
В целом, понимание связей и свойств вещества является фундаментальным для химической науки и играет ключевую роль в различных областях, таких как материаловедение, фармацевтика, энергетика и электроника. Благодаря прогрессу в изучении атомов и молекул, мы можем получить новые материалы и технологии, улучшить качество нашей жизни и сделать наш мир более безопасным и устойчивым.