Определение нуклонного состава химических соединений является важной задачей в области химии. Нуклоны – это протоны и нейтроны, составляющие ядро атома. Правильное определение нуклонного состава соединений позволяет установить, сколько протонов и нейтронов находится в атомах данного вещества, что в свою очередь может раскрыть причину его определенных свойств и химических реакций.
Одним из методов определения нуклонного состава химических соединений является спектроскопия. Спектроскопия позволяет проанализировать энергетический уровень атома, исключительно важный параметр для проведения данного исследования. С помощью спектроскопии можно определить, какие энергетические уровни присутствуют в атоме, а следовательно, и количество протонов и нейтронов в его ядре. Этот метод основан на способности вещества поглощать, испускать или рассеивать электромагнитную радиацию в зависимости от его структуры и состава.
Вторым методом для определения нуклонного состава является масс-спектрометрия. Этот метод позволяет определить массу атомов вещества и их суммарное количество. Один из основных шагов масс-спектрометрии – ионизация атомов соединения, которая осуществляется путем воздействия на вещество электронным пучком или при помощи химических реакций. Затем ионы разделяются по массе, после чего их масса измеряется специальными детекторами. По результатам масс-спектрометрии можно определить количество протонов и нейтронов в атомах и, следовательно, состав вещества.
Что такое нуклонный состав?

Протоны имеют положительный заряд, в то время как нейтроны не имеют заряда. Все атомы одного и того же элемента содержат одинаковое число протонов в ядре, называемое атомным номером. Это число определяет химические свойства элемента и его положение в таблице элементов.
Нуклонный состав может быть выражен в виде химической формулы, в которой указывается количество протонов и нейтронов в ядре атома. Например, химический элемент водород может быть представлен как H1, где 1 - это атомный номер, указывающий на один протон в ядре.
Нуклонный состав важен для определения стабильности и радиоактивности атомов. Нуклоны могут быть добавлены или удалены из атомного ядра с помощью ядерных реакций, что влияет на химические свойства соединений и их способность вступать в реакции.
Изучение нуклонного состава позволяет более полно понять физические и химические свойства химических соединений, а также их реакционную способность и стабильность.
Роль протонов и нейтронов
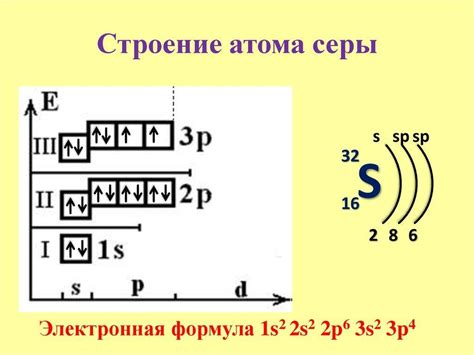
Протоны - это положительно заряженные частицы, которые находятся в ядре атома. Они имеют массу, примерно равную массе нейтрона, и их количество определяет атомный номер элемента. Протоны обладают зарядом +1 и их количество в ядре определяет расположение элемента в таблице периодических элементов.
Нейтроны - это нейтральные частицы, которые также находятся в ядре атома. Они не имеют заряда, и их количество может варьироваться в ядре одного и того же элемента. Нейтроны служат для уравновешивания протонного заряда в атоме и способствуют стабильности ядра.
Совокупность протонов и нейтронов в ядре атома определяет его массовое число. Массовое число является суммой протонов и нейтронов, а атомное число определяется только количеством протонов. Ядра атомов с одинаковым атомным числом, но различным массовым числом, называются изотопами.
Изменение нуклонного состава химического соединения может влиять на его свойства и химическую активность. Изучение роли протонов и нейтронов в химических соединениях позволяет лучше понять их структуру и свойства, что имеет практическое значение для различных областей науки и технологии.
Как определить нуклонный состав?

Существует несколько методов, которые можно использовать для определения нуклонного состава:
- Химический анализ: с использованием различных реакций и химических превращений, можно определить количество и тип атомов в соединении.
- Спектроскопия: спектроскопические методы, такие как ИК-спектроскопия, УФ-спектроскопия и ЯМР-спектроскопия, могут быть использованы для определения типа атома и его количества в соединении.
- Масс-спектрометрия: этот метод позволяет определить массу атомов в соединении и, следовательно, их количество.
Обычно, для более точного определения нуклонного состава, используется комбинация нескольких методов. Это позволяет получить более полную картину атомного и молекулярного строения соединения.
Определение нуклонного состава является важным инструментом в химии и может быть использовано для решения различных задач: от проверки чистоты вещества до разработки новых лекарственных препаратов и материалов.
Изотопы и их свойства
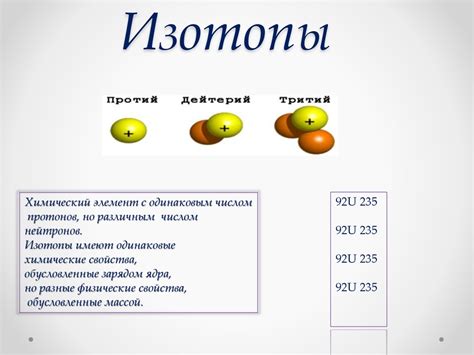
Изотопы имеют сходные химические свойства, так как электронная оболочка, которая определяет химические свойства атома, остается неизменной. Однако, изотопы могут иметь различную массу и стабильность.
Существуют стабильные и нестабильные (радиоактивные) изотопы. Стабильные изотопы не подвергаются самопроизвольному распаду и существуют в природе с определенной концентрацией. Нестабильные изотопы, напротив, подвергаются радиоактивному распаду с течением времени, превращаясь в другие элементы или другие изотопы того же элемента.
Изотопы могут использоваться в различных областях, включая науку, медицину и энергетику. Например, изотопы могут использоваться в радиоуглеродном анализе для определения возраста археологических находок, а также в радиотерапии для лечения рака.
Различия между изотопами

Изотопы химических элементов обычно различаются по своим массовым числам, которые представляют собой среднее арифметическое относительных атомных масс его изотопов, учитывая их процентное содержание. Различия в нуклонном составе могут привести к изменению массы атома. Например, углерод имеет два стабильных изотопа - углерод-12 и углерод-13. Углерод-12 имеет 6 протонов и 6 нейтронов в ядре, в то время как углерод-13 имеет 6 протонов и 7 нейтронов в ядре. Разница в количестве нейтронов может привести к различию в массе атомов, поэтому углерод-12 имеет массовое число 12, а углерод-13 - массовое число 13.
Изотопы также могут иметь различные периоды полураспада и степени радиоактивности. Некоторые изотопы химических элементов могут быть радиоактивными, что означает, что их ядра могут распадаться и испускать радиацию. Это может иметь важные последствия для использования изотопов в научных и медицинских исследованиях.
Различия между изотопами могут быть использованы для определенных целей, таких как радиоактивная датировка и определение происхождения образцов. Например, углерод-14, радиоактивный изотоп углерода, может быть использован для определения возраста органических материалов методом радиоуглеродного анализа. Это метод, позволяющий определить возраст органических образцов, поскольку концентрация углерода-14 в атмосфере остается относительно постоянной с течением времени.
Таким образом, различия между изотопами могут предоставить ценную информацию о свойствах химических соединений и их возрасте. Понимание этих различий позволяет ученым исследовать и понять мир вокруг нас на более глубоком уровне.
Использование изотопов в науке

Изотопы имеют широкое применение в различных областях науки. В ядерной медицине, например, они используются для диагностики и лечения различных заболеваний. Для этого в организм вводится радиоактивный изотоп, который обладает способностью накапливаться в определенной области тела. Затем при помощи специального оборудования можно обнаружить и изучить эту область, что помогает врачам поставить диагноз и назначить необходимое лечение.
Изотопы также используются в радиоуглеродном методе датировки. С помощью измерения содержания изотопа углерода-14 в органических материалах (например, в древесине или костях) можно определить возраст этих материалов. Этот метод широко применяется в археологии и геологии для изучения возраста артефактов и геологическихобразцов.
Необычные изотопы, такие как изотопы водорода и кислорода, могут использоваться для изучения процессов гидрологического цикла. Изотопный состав воды из озер, рек, океанов и даже ледников может дать ценную информацию о формировании и перемещении водных масс, а также о климатических изменениях.
Использование изотопов в науке позволяет получить ценные данные для понимания различных физических и химических процессов, а также для разработки новых технологий и методов исследования.
Массовая спектрометрия
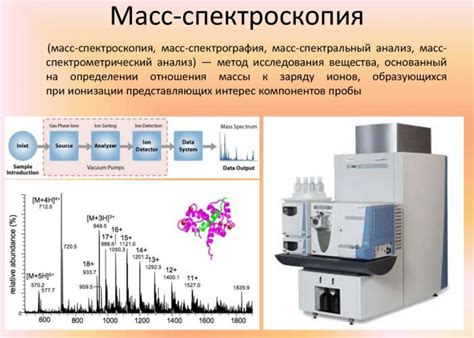
Масс-спектрометрия позволяет определить массу молекулы и ее фрагментов, а также установить молекулярную формулу. Этот метод часто используется в органической химии для исследования органических соединений, таких как углеводороды, аминокислоты и другие биологически активные молекулы.
Масс-спектрометрия имеет ряд преимуществ перед другими методами анализа. Во-первых, она позволяет получить точную массу молекулы с высокой точностью. Во-вторых, этот метод может быть применен для анализа малых количеств вещества, что особенно важно при анализе биологических образцов. В-третьих, масс-спектрометрия может быть использована для анализа сложных смесей веществ, помогая установить их состав и структуру.
Принцип работы массового спектрометра
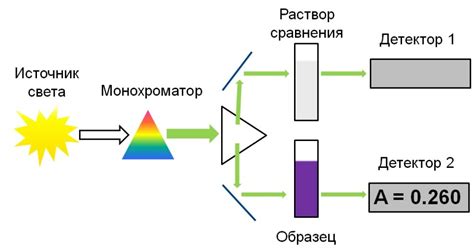
Основные компоненты массового спектрометра:
1. Ионизатор: преобразует атомы или молекулы в ионы, добавляя или удаляя электроны. В результате образуются положительно или отрицательно заряженные ионы.
2. Анализатор: разделяет ионы по их массе и заряду. Существуют различные типы анализаторов, такие как магнитный сектор, квадрупольный ионный клеточный или времяпролетный.
3. Детектор: регистрирует прохождение ионов и преобразует его в электрический сигнал. Электрический сигнал затем усиливается и записывается на компьютер или другое устройство для последующего анализа.
Процесс работы массового спектрометра начинается с ионизации образца, где атомы или молекулы преобразуются в ионы. Затем ионы вводятся в анализатор, который разделяет их по массе и заряду. Разделенные ионы затем достигают детектора, где они регистрируются и преобразуются в электрический сигнал.
Результаты измерений в массовом спектрометре представляются в виде спектра. Спектр состоит из пиков, каждый из которых соответствует определенному иону. По положению и интенсивности пиков можно определить массу и относительную концентрацию ионов в образце.
Массовый спектрометр имеет широкий спектр применений, включая анализ органических и неорганических соединений, изотопный анализ и исследование биологических молекул. При правильной калибровке и качественном обработке данных массовый спектрометр может быть незаменимым инструментом в многих областях научных исследований и промышленности.
Применение массовой спектрометрии в химии

Массовая спектрометрия предоставляет информацию о массе ионов, а также об их относительных абундантностях. Эта информация позволяет установить композицию и структуру химических соединений.
Массовая спектрометрия широко применяется в различных областях химии, включая аналитическую химию, органическую химию, неорганическую химию и физическую химию. С ее помощью можно анализировать различные типы образцов, включая органические соединения, биологические молекулы и металлорганические соединения.
Применение массовой спектрометрии позволяет идентифицировать неизвестные соединения, определять их структуру и массу, а также изучать химические реакции и процессы. Этот метод также может использоваться для определения изотопного состава элементов и изучения изотопных эффектов.
Основными компонентами масс-спектрометра являются ионизационный ионистор и детектор масс, которые работают вместе, чтобы ионизировать образец и анализировать его массовый спектр. Данные, полученные в результате, могут быть представлены в виде ионных диаграмм, массовых спектров или графиков.
Массовая спектрометрия – это мощный инструмент для исследования химических соединений и их свойств. Она позволяет углубить наше понимание молекулярной структуры и определить нуклонный состав химических соединений с высокой точностью.
Атомный абсорбционный спектрометр

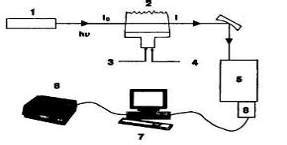
Работа атомного абсорбционного спектрометра основана на поглощении света атомами, которые находятся в возбужденном состоянии. При этом происходит переход атомов с низших энергетических уровней на более высокие. Принцип работы ААС заключается в измерении поглощения излучения анализируемыми атомами при определенной длине волны.
Атомный абсорбционный спектрометр состоит из нескольких основных компонентов, включая источник света, монокроматор, детектор и систему обработки данных. Вещество, содержащее анализируемый элемент, подвергается расщеплению на атомы путем нагревания или воздействия химических реакций.
Полученные атомы поглощают свет, который проходит через образец в ААС. Измерение поглощения света позволяет определить концентрацию элемента в образце с высокой точностью. Атомный абсорбционный спектрометр используется в различных областях, включая анализ пробы питьевой воды на наличие тяжелых металлов, определение концентрации макро- и микроэлементов в пищевых продуктах, анализ почвы и многое другое.
Принцип работы атомного абсорбционного спектрометра
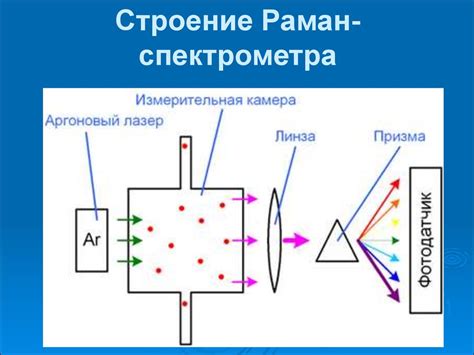
Основной принцип работы атомного абсорбционного спектрометра заключается в следующем: вещество, содержащее интересующий анализатор элемента, подвергается обработке, чтобы перевести его в атомное состояние. Затем образовавшиеся атомы проходят через пучок излучения с известной длиной волны, которая соответствует поглощению атомами данного элемента. Измеряется количество поглощенного излучения и на основании этих данных рассчитывается концентрация анализируемого элемента в образце.
Процесс работы ААС включает несколько ключевых этапов:
- Подготовка образца: Анализируемое вещество или раствор обрабатывается с помощью химических реагентов и особых условий, чтобы превратить его в атомное состояние и разделить от примесей.
- Ионизация и испарение: Атомы вещества, полученные в результате подготовки образца, испаряются и ионизируются в пламени, плазме или печи с высокой температурой.
- Пучок излучения: Источник света, обычно группа ламп с известной длиной волны излучения, излучает пучок данной длины волны, который направляется через испаренные атомы.
- Абсорбция излучения: Атомы элементов поглощают свет с определенными частотами, энергия которых соответствует разностям энергий между энергетическими уровнями атома. Это приводит к ослаблению интенсивности проходящего через образец излучения.
- Обнаружение и регистрация: Интенсивность пропущенного через образец излучения измеряется с помощью детектора. Затем полученные данные обрабатываются и анализируются с использованием соответствующего программного обеспечения.
Преимущества атомного абсорбционного спектрометра включают высокую точность, низкий предел обнаружения и способность анализировать различные элементы в разных образцах. Этот метод широко используется в различных областях, включая химическую и фармацевтическую промышленность, пищевую и наземную экологию, исследования горнодобывающих отраслей и др.
Применение атомного абсорбционного спектрометра в анализе веществ
Атомный абсорбционный спектрометр является мощным инструментом, который позволяет исследовать широкий спектр различных веществ и определять их состав. Он применяется в различных отраслях, включая анализ пищевых продуктов, воды, почвы, фармацевтических препаратов и многих других.
Преимущества использования атомного абсорбционного спектрометра в анализе веществ включают:
- Высокую чувствительность: атомный абсорбционный спектрометр может обнаруживать наличие даже малых концентраций элементов в образце.
- Широкий диапазон обнаружения: устройство способно определять содержание различных элементов, включая металлы, неметаллы и полуметаллы.
- Высокую точность и повторяемость результатов: атомный абсорбционный спектрометр обеспечивает высокую точность и воспроизводимость при измерении содержания элементов в веществах.
- Относительно низкие затраты на обслуживание: атомный абсорбционный спектрометр не требует дорогостоящих реагентов и расходуемых материалов.
В целом, атомный абсорбционный спектрометр является незаменимым инструментом для анализа веществ и позволяет получать точные и надежные результаты. Благодаря его применению, ученые и специалисты в разных областях могут изучать состав различных веществ и проводить качественный анализ с высокой степенью точности и надежности.