Энзимы представляют собой биологические катализаторы, играющие важную роль в различных процессах, происходящих в клетках организма. Они являются ключевыми участниками метаболических путей и позволяют ускорить химические реакции, происходящие внутри клетки. Без энзимов биохимические реакции в организме могли бы происходить слишком медленно или вообще не происходить.
Принцип работы энзимов основан на их способности связываться с молекулами субстратов и ускорять химическую реакцию, превращая субстраты в продукты. Существует множество различных типов энзимов, каждый из которых специфичен к определенному субстрату. Это позволяет энзимам выполнять свои функции с высокой точностью и эффективностью.
Процесс действия энзимов можно разделить на несколько этапов. Вначале происходит связывание энзима с субстратом, образуя комплекс энзим-субстрат. Затем энзим катализирует реакцию, превращая субстрат в продукты. После завершения реакции продукты отсоединяются от энзима, который остается готовым к повторному связыванию с новым субстратом.
Принцип работы энзимов: важные аспекты
Принцип работы энзимов основан на специфичности и их возможности связываться только с определенными молекулами, называемыми субстратами. Энзимы имеют активный участок, который распознает и связывается с субстратами, что дает возможность проведения химической реакции.
- Ферментационная активность: энзимы способны ускорять химические реакции в несколько тысяч раз, создавая оптимальные условия для протекания процесса.
- Специфичность: каждый энзим способен связываться только с определенным субстратом, обусловленным его трехмерной структурой и взаимодействием с активным участком энзима.
- Регуляция активности: энзимы могут быть активированы или ингибированы, что позволяет организму контролировать скорость и направление биохимических реакций.
- Кофакторы и коэнзимы: некоторые энзимы требуют наличия специальных молекул, называемых кофакторами или коэнзимами, чтобы функционировать эффективно.
Принцип работы энзимов может быть описан с помощью модели "замка и ключа", где энзим (ключ) точно подходит к субстрату (замку) и активирует реакцию. Эта специфичность энзимов является основой для их широкого применения в промышленности и медицине.
Действие энзимов на биохимические реакции
Действие энзимов на реакции происходит благодаря их активным центрам, которые обладают специфическими свойствами. Эти центры могут связываться с молекулами субстрата, образуя комплекс энзим-субстрат. В результате образования комплекса происходит замена химических связей, что приводит к образованию новых молекул – продуктов реакции.
Энзимы могут ускорять реакции, увеличивая стабильность переходного состояния реакции и снижая энергию активации. Кроме того, они могут снижать энергию активации, участвуя в образовании или разрыве химических связей.
Помимо этого, энзимы способны к регуляции биохимических процессов, влияя на скорость реакций. Они могут быть активированы или ингибированы различными факторами, такими как pH, температура и концентрация субстрата.
Благодаря своим специфическим свойствам, энзимы обеспечивают плавное и эффективное протекание биохимических реакций в организме. Их действие позволяет контролировать обмен веществ и поддерживать гомеостаз – стабильную внутреннюю среду организма.
Основные классы энзимов и их функции
Оксидоредуктазы – энзимы, ответственные за процессы окисления и восстановления. Они участвуют, например, в дыхании, переносе электронов и синтезе некоторых важных соединений.
Трансферазы – энзимы, которые катализируют перенос групп функциональных молекул с одной молекулы на другую. Они играют важную роль в метаболических процессах, генетической информации и синтезе белков.
Гидролазы – энзимы, которые катализируют гидролиз химических связей, разрушая молекулы. Они включают в себя, например, энзимы, разрушающие углеводы, липиды и протеины.
Лиазы – энзимы, которые катализируют разрыв или образование связей в молекулах. Они участвуют во многих биохимических реакциях, включая процессы синтеза и разрушения веществ.
Изомеразы – энзимы, которые катализируют превращение молекулы в другую изомерную форму. Они играют важную роль в обмене веществ и метаболических путях.
| Класс энзимов | Функции |
|---|---|
| Липазы | Катализ разложения липидов |
| Протеазы | Катализ разлагания протеинов |
| Амилазы | Катализ разложения углеводов, особенно крахмала и гликогена |
| Глутатион-с-трансфераза | Катализ передачу глутатионов на различные молекулы |
Коферменты: помощники энзимов

Энзимы играют важную роль в биохимических реакциях, ускоряя их процесс. Однако, они не могут функционировать без помощи так называемых коферментов.
Коферменты – это молекулы, которые сотрудничают с энзимами, образуя активные центры и взаимодействуя с субстратами. Они помогают энзимам выполнять их функции гораздо более эффективно.
Основное свойство коферментов – их способность переносить химические группы или электроны от одной молекулы к другой. Благодаря этому, коферменты играют решающую роль во многих реакциях органического синтеза и распада в клетке.
Коферменты могут существовать в двух формах: активной и неактивной. В неактивной форме они называются косубстратами. При взаимодействии с энзимами, косубстраты претерпевают изменения и активируются, образуя активные коферменты.
Одним из наиболее известных коферментов является никотинамидадениндинуклеотид (NAD+). Он широко применяется в многих окислительно-восстановительных реакциях, перенося электроны от одной молекулы к другой.
Важно отметить, что без наличия коферментов энзимы не имели бы возможности активироваться и выполнять свои функции. Поэтому, коферменты справедливо называются "помощниками энзимов".
Субстраты и активные центры энзимов
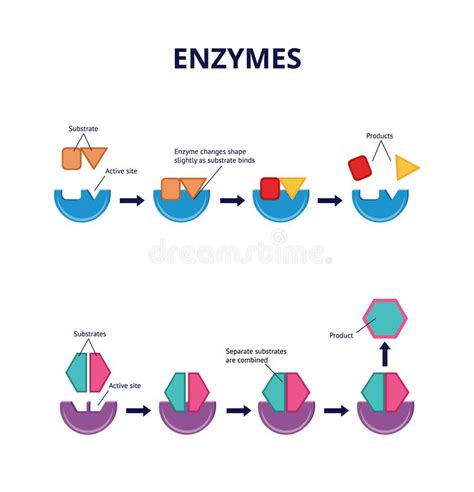
Одним из основных аспектов функционирования энзимов является их способность связываться с определенными веществами, называемыми субстратами. Субстраты вступают в реакцию с энзимами в активном центре – уникальной структурной области энзима, способной катализировать химическую реакцию.
Активный центр энзима обладает определенной формой, определяющей специфичность энзима к субстрату. Именно эта специфичность позволяет энзиму выбирать и связываться только с определенными субстратами и пространственно ориентироваться внутри молекулы субстрата. Энзимы могут быть очень избирательными и распознавать только определенные вещества.
Процесс взаимодействия энзима с субстратом может происходить в несколько стадий, включая связывание, превращение субстрата и высвобождение продукта реакции. Однако наиболее важным этапом является связывание субстрата в активном центре, где происходит перераспределение электронов и протонов, что ведет к изменению структуры субстрата и протеканию реакции.
Субстраты энзимов могут быть органическими или неорганическими веществами, такими как углеводы, липиды, белки и нуклеотиды. Каждый энзим обладает своим набором субстратов, с которыми он может взаимодействовать и катализировать определенные реакции.
Важно отметить, что энзимы не расходуются во время реакции и способны использоваться повторно для катализа следующих реакций. Они также не меняют химическую природу субстрата, а лишь ускоряют его превращение и облегчают процесс образования продукта.
В итоге, понимание субстратов и активных центров энзимов является важным аспектом для понимания механизмов и процессов действия энзимов. Это позволяет объяснить специфичность энзимов, их уникальные свойства и значимость для живых организмов.
Механизмы катализа энзимов
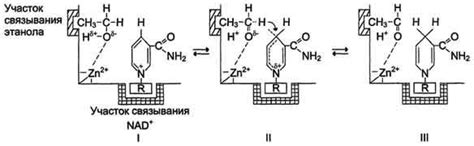
Один из важных механизмов катализа - ориентация субстрата. Энзим активно взаимодействует со своим субстратом, располагая его таким образом, чтобы реакционные группы находились в оптимальном положении для протекания химической реакции. Это помогает снизить энергетический барьер и увеличить скорость реакции.
Другой механизм - ионизация субстрата. Энзим может взаимодействовать с субстратом таким образом, что его химическая структура изменяется, что приводит к образованию ионов или активированных форм молекул. Это увеличивает вероятность химической реакции и позволяет ей протекать быстрее.
Также энзимы могут катализировать реакции путем формирования временных связей с субстратом. Это позволяет удерживать субстрат в определенном положении, чтобы реакция протекала более эффективно. Энзим может также изменить конформацию субстрата, превратив его в более активное состояние.
Очень важный механизм катализа - снижение энергетического барьера. Энзимы способны уменьшить энергию, необходимую для протекания реакции, путем изменения конформации субстрата или участия в образовании промежуточных комплексов, которые стабилизируются энзимом.
И, наконец, энзимы также могут катализировать реакции, участвуя в процессе передачи электронов от одного субстрата к другому. Они могут выступать в роли переносчиков электронов или активировать другие молекулы, которые затем участвуют в электронном переносе.
Механизмы катализа энзимов являются сложными и разнообразными. Каждый энзим имеет свой уникальный механизм действия, что позволяет ему выполнять свою специфическую функцию в организме. Понимание этих механизмов позволяет в будущем разрабатывать более эффективные лекарственные препараты и биотехнологические процессы.
Температурные условия для оптимальной работы энзимов

Одной из ключевых характеристик энзимов является их способность работать при определенной температуре. Каждый энзим имеет оптимальную температуру, при которой он функционирует наиболее эффективно. Это связано с его структурой и активностью.
Оптимальная температура для работы энзимов может быть разной в зависимости от конкретного организма. Некоторые энзимы наиболее активны при температуре тела (около 37°C), что делает их идеальными для работы внутри нашего организма.
Однако существуют и энзимы, которые функционируют при более высоких или более низких температурах. Например, энзимы, обитающие в горячих источниках, могут работать при температурах от 60 до 80°C. Такие энзимы называют термофильными.
Температурные условия для оптимальной работы энзимов могут также зависеть от pH окружающей среды. Некоторые энзимы могут быть активными только в кислых средах, в то время как другие работают лучше в щелочной среде.
Важно отметить, что выше или ниже оптимальной температуры энзимы могут терять свою активность или разрушаться. Это связано с изменением их структуры, что приводит к потере способности катализировать химические реакции.
Понимание температурных условий для оптимальной работы энзимов имеет значительное значение в биологических и медицинских исследованиях. Это позволяет управлять и контролировать активность энзимов, а также предсказывать их поведение в различных условиях.
Конкретные примеры действия энзимов в организме

Протеазы: это энзимы, которые разрушают протеины на более мелкие фрагменты – пептиды и аминокислоты. Они играют ключевую роль в пищеварении белков, разлагая их в пищеварительном тракте на более усваиваемые компоненты.
Липазы: эти энзимы разрушают жиры на молекулы глицерина и жирных кислот. Они также выполняют важную роль в пищеварении, помогая организму усваивать жирные кислоты и витамины растворимые в жирах.
Амилазы: энзимы, которые разрушают полисахариды (состоящие из множества сахарных молекул) на моносахариды. Они играют важную роль в пищеварении углеводов, помогая разбивать исходные полисахариды на более мелкие молекулы, которые могут быть усвоены организмом.
ДНК-полимеразы: эти энзимы отвечают за синтез ДНК в организме. Они играют важную роль в репликации ДНК перед делением клеток. ДНК-полимеразы помогают воссоздавать стройную и точно копирующуюся молекулу ДНК.
Рибозомы: это особые структуры, находящиеся в клетках, которые выполняют функцию синтеза белков по информации, содержащейся в РНК. Они своего рода "фабрики", где происходит процесс синтеза белковых цепочек.
Это лишь некоторые примеры действия энзимов в организме. Уникальная специфичность действия каждого энзима делает их незаменимыми в регуляции метаболических процессов и поддержании жизнедеятельности.
Возможность регулировки активности энзимов

Существует несколько механизмов, которые позволяют контролировать активность энзимов. Один из них – изменение концентрации субстрата. Увеличение концентрации субстрата обычно приводит к увеличению скорости реакции, так как больше субстратов доступно для связывания с активными центрами энзима. При достижении определенной концентрации субстрата реакция может насытиться, и дальнейшее увеличение концентрации не будет повышать активность энзима. Этот механизм называется контролем по концентрации субстрата.
Другим механизмом регулировки активности энзимов является изменение показателя pH. Многие энзимы работают в определенном диапазоне pH и изменение pH может влиять на их активность. Например, пепсин, энзим, разрушающий белки в желудке, активен только в кислой среде. При изменении pH в сторону щелочной или кислотной стороны, активность пепсина будет снижаться. Таким образом, изменение pH позволяет организму контролировать работу энзимов, связанных с определенными физиологическими процессами.
Еще одним важным механизмом регулировки активности энзимов является наличие ингибиторов или активаторов. Ингибиторы могут связываться с энзимом и заблокировать его активность, тогда как активаторы могут повышать его активность. Это позволяет организму гибко регулировать работу различных энзимов в зависимости от текущих потребностей.
Сочетание различных механизмов регулировки активности энзимов позволяет организму эффективно контролировать ход биохимических реакций и поддерживать необходимое равновесие в клетках и органах. Понимание этих механизмов имеет важное значение для разработки методов лечения и диагностики различных заболеваний, связанных с нарушениями активности энзимов.