Химические реакции - основной элемент химической науки, и изучение их принципов и механизмов является ключевой задачей химиков. Химические реакции являются превращениями вещества, при которых происходит изменение исходных веществ - реагентов - в новые вещества - продукты. Процесс химической реакции сопровождается изменением атомного и молекулярного строения вещества, а также изменением энергии, связей и химических свойств.
Принципы химических реакций основываются на законах сохранения массы, энергии и заряда. Закон сохранения массы утверждает, что во время химической реакции общая масса реагентов должна быть равна общей массе продуктов. Закон сохранения энергии гласит, что энергия не может быть создана или уничтожена в ходе реакции - она может только превращаться из одной формы в другую. Закон сохранения заряда устанавливает, что в химической реакции сумма зарядов реагентов должна быть равной сумме зарядов продуктов.
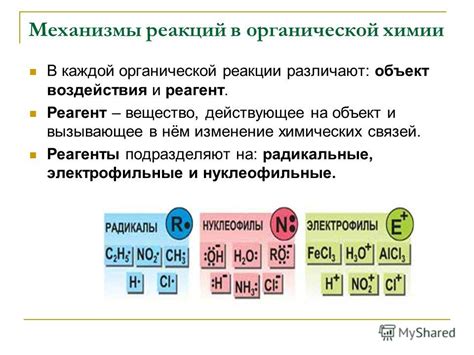
Механизмы химических реакций описывают шаги, по которым происходит превращение реагентов в продукты. Они позволяют понять, как происходят эти реакции и почему некоторые реакции проходят быстро, а некоторые - медленно. Механизмы включают в себя различные стадии реакции, такие как образование активированных комплексов, разрыв и формирование химических связей, перераспределение электронной плотности и т.д.
Изучение принципов и механизмов химических реакций позволяет химикам прогнозировать и контролировать результаты реакций, разрабатывать новые вещества и материалы с определенными свойствами, а также создавать новые методы синтеза и обработки веществ. Понимание основных закономерностей и законов химических реакций является основой для развития химической науки и применения химии в различных областях науки и промышленности.
Принципы и механизмы химических реакций
Химические реакции играют важную роль во многих аспектах нашей жизни, поддерживая баланс и разнообразие в природе, а также служа основой для промышленных процессов. Понимание принципов и механизмов химических реакций позволяет не только контролировать и оптимизировать процессы, но и разрабатывать новые материалы и технологии.
Принципы химических реакций основаны на законах сохранения массы и энергии. Закон сохранения массы утверждает, что общая масса реагентов перед реакцией равна общей массе продуктов после реакции. Это значит, что атомы не могут исчезать или появляться из ниоткуда в ходе химической реакции. Закон сохранения энергии связан с сохранением энергии в процессе реакции. Энергия может быть перераспределена, но общая энергия системы остается постоянной.
Механизмы химических реакций – это последовательность шагов, позволяющая объяснить, как реагенты превращаются в продукты. Механизмы включают в себя различные этапы реакции, такие как проникновение реагентов на поверхность друг друга, образование промежуточных соединений и разрушение связей, а также образование новых связей.
Химические реакции могут происходить с разной скоростью, и эту скорость можно изменять, влияя на различные факторы, такие как температура, концентрация реагентов, поверхность и наличие катализаторов. Изучение принципов и механизмов химических реакций позволяет оптимизировать эти факторы для получения желаемых продуктов с максимальной эффективностью и минимальными затратами.
Изучение принципов и механизмов химических реакций имеет важное практическое значение. Оно позволяет разрабатывать и улучшать материалы и технологии для различных отраслей промышленности, таких как фармацевтика, пищевая промышленность и энергетика. Также, при изучении принципов химических реакций, можно применять и инновационные методы, такие как компьютерное моделирование, для предсказания результатов реакций и создания новых веществ и материалов.
Ключевые аспекты

Скорость реакции: скорость реакции определяет, как быстро реагенты превращаются в продукты. Она зависит от концентрации реагентов, температуры, поверхности контакта, наличия катализаторов и других факторов.
Направленность реакции: химические реакции могут протекать в разных направлениях. Реакции, протекающие в одном направлении, называются неравновесными, а реакции, протекающие в обоих направлениях, называются равновесными. Направленность реакции определяется принципом Ле-Шателье и законом Гулберта-Мэталле.
Энергетическая сторона реакции: химические реакции сопровождаются изменением энергии. Реакции, сопровождающиеся выделением энергии, называются экзоэнергическими, а реакции, требующие поглощения энергии, называются эндоэнергическими. Для описания энергетической стороны реакций используют понятия энтальпии, свободной энергии и энтропии.
Реакционный механизм: реакционный механизм описывает последовательность этапов, через которые проходит химическая реакция. Важными аспектами реакционного механизма являются активированное состояние, промежуточные продукты, переходные состояния и катализаторы. Реакционный механизм может быть одношаговым или состоять из нескольких ступеней.
Кинетика реакций: кинетика реакций изучает скорость реакций и ее зависимость от разных факторов. Важной частью кинетики является определение скоростного закона реакции, который связывает скорость реакции с концентрацией реагентов.
Химическое равновесие: химическое равновесие описывает состояние системы, при котором скорости прямой и обратной реакций становятся равными. Это основной принцип, на котором основано большинство реакций в природе и в промышленности из-за практической невозможности достижения полного превращения реагентов в продукты и поддержания реакции в едином направлении.
Ключевые аспекты химических реакций, такие как скорость, направленность, энергетическая сторона, реакционный механизм, кинетика и равновесие, играют важную роль в понимании и изучении химических процессов и являются основополагающими для многих областей химии и промышленности.
Основные закономерности
Химические реакции подчиняются определенным закономерностям, которые определены фундаментальными принципами и принципами химии. Некоторые из основных закономерностей, которые наблюдаются в химических реакциях, включают следующее:
| Закономерность | Описание |
|---|---|
| Закон сохранения массы | Масса всех реактивов, участвующих в реакции, равна массе всех продуктов реакции. |
| Закон постоянных пропорций | В химической реакции между различными элементами соединение всегда образуется в одной и той же фиксированной пропорции. |
| Закон множественного соотношения | Если два элемента образуют несколько соединений, то масса одного элемента, сочетающаяся с фиксированной массой другого элемента, образует простые и целые числа. |
| Закон Гей-Люссака | Для реагентов и продуктов газовых реакций отношение объемов газов пропорционально их стехиометрическим коэффициентам. |
| Закон Авогадро | Объем газа пропорционален количеству молекул вещества при постоянной температуре и давлении. |
Эти закономерности играют важную роль в понимании и исследовании химических реакций. Их знание позволяет предсказывать результаты реакций и разрабатывать новые методы синтеза веществ.