Эквивалентная масса является важной характеристикой химических веществ и определяется как масса вещества, которая реагирует с одним электроном, либо с замещением одного атома в соединении.
Когда речь идет о поиске эквивалентной массы кислоты H3AsO4, важно сначала понять, что каждый молекулы этой кислоты содержит соединение арсената (AsO4), состоящее из атома арсенида и четырех атомов кислорода.
Чтобы найти эквивалентную массу H3AsO4, необходимо узнать его молярную массу и количество замещаемых атомов в реакции. Затем следует определить количество эквивалентов, которые анализируемое количество H3AsO4 представляет. Это можно сделать, поделив молярную массу на количество замещаемых атомов.
Что такое эквивалентная масса?
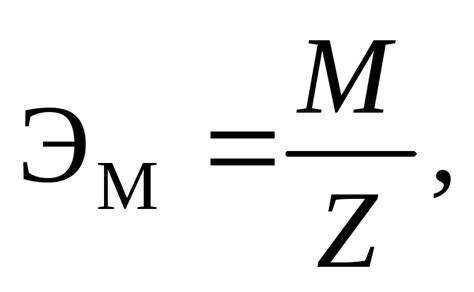
Эквивалентная масса является характеристикой химического элемента или соединения и позволяет нам сравнивать их взаимодействие с другими веществами. Она определяется отношением молярной массы вещества к его валентности.
Например, для кислоты H3AsO4 эквивалентная масса будет равна молярной массе вещества, деленной на сумму валентностей всех протонов, по которым она может отдавать водород и реагировать с другими веществами.
Зная эквивалентную массу кислоты H3AsO4, мы можем использовать ее для расчета количества вещества, взаимодействующего с данной кислотой во время химической реакции. Это позволяет нам определить оптимальное соотношение реагентов и прогнозировать результаты реакции.
Таким образом, знание эквивалентной массы важно для понимания и изучения химических реакций и процессов, а также для точного проведения расчетов в химической науке.
Зачем нужно находить эквивалентную массу кислоты H3AsO4?

Определение эквивалентной массы кислоты H3AsO4 позволяет определить, сколько граммов этой кислоты содержится в одном эквиваленте. Эта информация полезна для проведения различных расчетов, связанных с реакциями, в которых участвуют кислоты H3AsO4 и другие реагенты.
Знание эквивалентной массы также позволяет определить массу кислоты H3AsO4, необходимую для проведения определенной реакции или достижения определенного результата. Например, при подготовке растворов кислоты H3AsO4 нужно знать, сколько граммов кислоты нужно растворить для получения определенной концентрации раствора.
В общем, нахождение эквивалентной массы кислоты H3AsO4 является необходимым шагом в химических расчетах и позволяет более точно планировать и проводить различные химические процессы.
Методы нахождения эквивалентной массы

Существуют различные методы для нахождения эквивалентной массы, включая:
- Метод электролиза: этот метод основан на использовании электрического тока для разложения вещества на ионы. Зная количество частиц, вызывающих электролиз, и ток, прошедший через раствор, можно вычислить эквивалентную массу.
- Метод титрования: данный метод используется для определения концентрации вещества в растворе путем реакции с известным объемом раствора с известной концентрацией. Используя полученные данные, можно вычислить эквивалентную массу.
- Метод газовой вязкости: этот метод основан на измерении скорости движения газовых частиц через определенное расстояние. Учитывая массу газовых частиц и их скорость, можно вычислить эквивалентную массу.
- Метод мольной проводимости: данный метод основан на измерении проводимости раствора с известной концентрацией вещества. Учитывая проводимость и концентрацию вещества, можно вычислить эквивалентную массу.
- Метод выпадения осадка: этот метод основан на использовании химической реакции с образованием осадка. Известная масса осадка и количество вещества, вызывающего его выпадение, позволяют вычислить эквивалентную массу.
Выбор метода для нахождения эквивалентной массы зависит от особенностей исследуемого вещества и доступных лабораторных возможностей. Комбинирование разных методов может дать более точные результаты.
Важно отметить, что эквивалентная масса может меняться в зависимости от условий реакции, поэтому необходимо учитывать все факторы при ее расчете.
Метод ионов

Шаги метода ионов:
- Установите ионы и их заряды в уравнении реакции.
- Соберите информацию о концентрации ионов и их зарядов.
- Составьте ионные уравнения для реакции кислоты и щелочи.
- Используйте баланс ионов и их зарядов, чтобы определить эквивалентную массу кислоты.
Пример:
Рассмотрим реакцию между кислотой H3AsO4 и щелочью NaOH:
H3AsO4 + 3NaOH → Na3AsO4 + 3H2O
Ионное уравнение:
H+ + 3OH- → 3H2O
Балансируя ионы и их заряды, мы видим, что 1 ион H+ соответствует 3 ионам OH-. Таким образом, эквивалентная масса кислоты H3AsO4 равна массе 3 ионов OH-.
Используя метод ионов, можно точно определить эквивалентную массу кислоты H3AsO4 и других кислот.
Метод титрования

Для проведения титрования необходимо приготовить раствор кислоты H3AsO4 нужной концентрации и точно измерить его объем. Затем, используя бюретку, постепенно добавляют щелочной раствор (например, NaOH) к раствору кислоты до тех пор, пока не наступит точка эквивалентности.
Точка эквивалентности – это момент, когда количество добавленной щелочи становится равным количеству протонов, присутствующих в исходной кислоте. Она определяется по изменению цвета индикатора, который используется для визуализации процесса титрования.
Измерив точный объем добавленного щелочного раствора, можно рассчитать эквивалентную массу кислоты H3AsO4. Для этого необходимо знать концентрации щелочного раствора и количество щелочи, использованной для нейтрализации.
Титрование является очень точным методом определения эквивалентной массы кислоты H3AsO4, так как позволяет измерить количество добавленной щелочи точно и определить точку эквивалентности с высокой точностью. Он широко используется в химическом анализе и научных исследованиях для определения содержания различных веществ.
Шаг 1: Определение молярной массы H3AsO4

Молярная масса (M) кислоты H3AsO4 определяется как сумма атомных масс всех элементов, входящих в ее состав.
Для определения молярной массы H3AsO4, нам необходимо знать атомные массы элементов: водорода (H), мышьяка (As) и кислорода (O).
Согласно периодической системе элементов, атомная масса водорода (H) составляет примерно 1 г/моль, а атомная масса мышьяка (As) равна примерно 74,9 г/моль.
Атомная масса кислорода (O) равна примерно 16 г/моль.
Таким образом, суммируя атомные массы всех элементов в молекуле H3AsO4, мы можем определить молярную массу:
| Элемент | Атомная масса (г/моль) | Количество атомов в молекуле | Масса элемента в молекуле (г/моль) |
|---|---|---|---|
| Водород (H) | 1 | 3 | 3 |
| Мышьяк (As) | 74,9 | 1 | 74,9 |
| Кислород (O) | 16 | 4 | 64 |
| Общая молярная масса H3AsO4 | 141,9 г/моль |
Таким образом, молярная масса H3AsO4 составляет приблизительно 141,9 г/моль.
Шаг 2: Нахождение числа замещений

Чтобы найти эквивалентную массу кислоты H3AsO4, необходимо знать количество замещений в молекуле кислоты. Число замещений определяет, сколько атомов водорода в кислоте может быть замещено другими элементами или группами.
Для кислоты H3AsO4 число замещений можно определить следующим образом:
- Найдите центральный атом в молекуле кислоты. В данном случае центральным атомом является атом арсения (As).
- Определите, сколько атомов водорода присоединено к центральному атому. В данном случае к атому арсения присоединено 3 атома водорода.
- Определите, какие атомы или группы могут замещать атомы водорода. В данном случае атомы кислорода и атомы гидроксила (OH) могут замещать атомы водорода.
- Определите, сколько атомов атомов кислорода или групп гидроксила (OH) может замещать один атом водорода. В данном случае каждый атом кислорода и каждая группа гидроксила (OH) может замещать один атом водорода.
- Умножьте количество атомов водорода на количество атомов или групп, которые могут замещать каждый атом водорода. В данном случае у нас есть 3 атома водорода и каждый из них может быть замещен одним атомом кислорода или группой гидроксила (OH).
Таким образом, для кислоты H3AsO4 число замещений равно 3*1=3.
Шаг 3: Расчет эквивалентной массы

Эквивалентная масса кислоты H3AsO4 может быть рассчитана, используя формулу:
Эквивалентная масса (EM) = Молярная масса (MM) / Молярность (n)
Перед тем как начать расчет, необходимо знать молярную массу кислоты H3AsO4 и ее молярность.
- Молярная масса кислоты H3AsO4 можно найти, умножив атомную массу каждого элемента в формуле на его коэффициент и сложив полученные значения.
- Молярность кислоты H3AsO4 можно определить, рассмотрев соотношение между H3AsO4 и водой в химическом уравнении, если такое уравнение имеется.
После получения значений молярной массы и молярности, эквивалентная масса H3AsO4 может быть рассчитана путем деления молярной массы на молярность.
Это позволяет определить, сколько граммов кислоты H3AsO4 содержится в одном эквиваленте.
Важно помнить, что расчет эквивалентной массы основывается на предположении, что кислота полностью диссоциирована и каждый эквивалент кислоты H3AsO4 реагирует с одним эквивалентом другого соединения.
Пример решения:

Для нахождения эквивалентной массы кислоты H3AsO4 используем следующий подход:
1. Найдем молярную массу кислоты H3AsO4. Сумма молярных масс атомов будет равна 1+3(1)+75(1)+16(4) = 181 г/моль.
2. Чтобы найти эквивалентную массу, надо поделить молярную массу на количество заместителей кислоты. В данном случае основным заместителем является водород (H). Количество заместителей в кислоте H3AsO4 равно 3.
3. Рассчитаем эквивалентную массу: 181 г/моль / 3 = 60.33 г/экв.
Итак, эквивалентная масса кислоты H3AsO4 составляет 60.33 г/экв.