Амфотерный оксид - это химическое соединение, которое может реагировать как с кислотами, так и с щелочами. Такое свойство позволяет амфотерным оксидам быть многофункциональными и использоваться во многих процессах и отраслях науки и промышленности.
Определить, является ли оксид амфотерным, можно несколькими простыми способами. Во-первых, можно протестировать его реакцию с кислотой. Если оксид сразу растворяется и образуется соль, то это говорит о его амфотерных свойствах. Во-вторых, можно проверить его реакцию с щелочью. Если оксид образует соль и воду, то это также указывает на его амфотерность.
Существуют некоторые общие правила для определения амфотерных оксидов. Например, большинство оксидов переходных металлов обладают амфотерными свойствами, так как они способны принимать разные степени окисления. Однако есть и исключения, например, оксид алюминия (Al2O3), который также является амфотерным оксидом.
Знание свойств амфотерных оксидов важно для понимания химических процессов, происходящих в природе и технологической сфере. Частью этого понимания является умение простыми способами определить, является ли оксид амфотерным. Это позволяет нам более эффективно использовать и применять эти соединения в нашей повседневной жизни.
Амфотерные оксиды: что это такое?
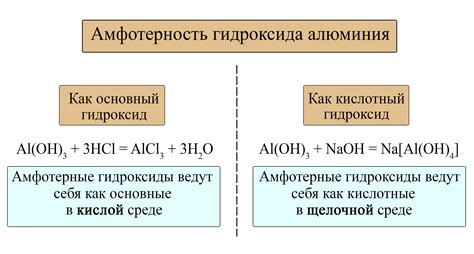
Для определения амфотерных оксидов можно использовать простую систему правил:
- Амфотерные оксиды реагируют с кислотами, проявляя свойства основания. В результате такой реакции образуется соль и вода.
- Амфотерные оксиды также реагируют с щелочами, проявляя свойства кислоты. При такой реакции образуется соль и вода.
- Амфотерные оксиды имеют в своей структуре металл и кислород.
Некоторые примеры амфотерных оксидов:
Алюминий оксид (Al2O3) - реагирует как с кислотами, так и с щелочами, образуя алюминаты и алюминаты. Используется в производстве керамики и в качестве катализатора.
Цинковый оксид (ZnO) - обладает амфотерными свойствами и используется в качестве защитного покрытия на металлических поверхностях.
Свинцовый оксид (PbO) - также является амфотерным оксидом и активно используется в производстве стекла и керамики.
Амфотерные оксиды играют важную роль в химии и промышленности благодаря своим уникальным свойствам и широкому спектру применений.
Определение амфотерного оксида

Существует несколько способов определения амфотерного оксида:
- Реакция с кислотой: если оксид реагирует с кислотой и образует соль и воду, то он является амфотерным. Примером такого оксида является оксид алюминия (Al2O3), который при реакции с соляной кислотой (HCl) образует соль алюминия (AlCl3) и воду (H2O).
- Реакция с основанием: если оксид реагирует с основанием и образует соль и воду, то он также является амфотерным. Например, оксид цинка (ZnO) при взаимодействии с натриевым гидроксидом (NaOH) образует соль цинка (Na2ZnO2) и воду (H2O).
- Определение амфотерности по свойству оксида образовывать гидроксиды: амфотерные оксиды могут образовывать гидроксиды, которые имеют как кислотные, так и основные свойства. Например, оксид железа (Fe2O3) образует гидроксид железа (Fe(OH)3), который может реагировать как с кислотами, так и с основаниями.
Определение амфотерного оксида может быть полезным при изучении химических реакций и свойств веществ. Это свойство отличает амфотерные оксиды от других типов оксидов и позволяет им проявлять разнообразные химические реакции.
Свойства и характеристики амфотерных оксидов

Одним из характерных свойств амфотерных оксидов является амфотерность. Это означает, что они способны реагировать как с кислотами, образуя соли, так и с основаниями, образуя соединения типа гидроксида. Данная реакция может идти в разных направлениях в зависимости от условий.
Реакция амфотерных оксидов с кислотами: В присутствии кислот амфотерные оксиды могут проявлять свои свойства оснований. Они отдают свои электроны, образуя ион гидроксида и образуя соль. Примером такой реакции может служить реакция оксида алюминия (Al2O3) с соляной кислотой (HCl), в результате которой образуется хлорид алюминия (AlCl3) и вода (H2O).
Реакция амфотерных оксидов с основаниями: В присутствии оснований амфотерный оксид может проявить свои кислотные свойства. Он примет электроны от основания, формируя ион гидроксида и образуя соль. Например, оксид цинка (ZnO) реагирует с гидроксидом натрия (NaOH), при этом образуется гидроксид цинка (Zn(OH)2) и соль натрия (Na2O).
Амфотерные оксиды также обладают другими характерными свойствами. Они могут растворяться в кислотах и основаниях, образуя соответствующие соли и вещества. Вода является растворителем для амфотерных оксидов, и они образуют с ней гидроксиды или образуют кислотные или щелочные растворы в зависимости от своих реакционных свойств.
Важно отметить, что реакция амфотерных оксидов с кислотами или основаниями зависит от рН среды и концентрации реагентов. Нейтральные условия являются наиболее благоприятными для образования солей, в то время как кислотные или щелочные условия способствуют формированию гидроксидов.
Примеры амфотерных оксидов
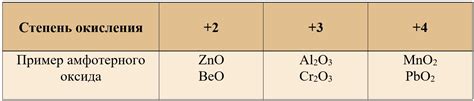
Ниже приведены примеры некоторых известных амфотерных оксидов:
- Алюминий оксид (Al2O3) - этот оксид используется в производстве керамики и стекла. Он реагирует как с кислотами, так и с основаниями, образуя соответствующие соли и воду.
- Цинковый оксид (ZnO) - этот оксид широко используется в промышленности, включая производство пигментов и солнцезащитных средств. Он также проявляет свойства амфотерного оксида.
- Свинцовый оксид (PbO) - этот оксид используется в производстве керамики и стекла. Он взаимодействует как с кислотами (образуя соответствующие соли), так и с основаниями (образуя соответствующие гидроксиды).
- Бериллиевый оксид (BeO) - этот оксид, несмотря на свой небольшой размер, проявляет амфотерность и может взаимодействовать как с кислотами, так и с основаниями.
Эти примеры показывают, что амфотерные оксиды широко распространены и имеют важное промышленное и химическое значение.
Способы определения амфотерных оксидов

Определение амфотерных оксидов можно осуществить с помощью нескольких простых способов и правил.
Первый способ – использование фенолфталеина в качестве индикатора. Для этого добавляют вещество к раствору оксида. Если раствор окрасится в розовый цвет, то оксид является основанием. Если раствор не окрасится, то оксид является кислотой.
Второй способ – проведение нейтрализационной реакции с помощью кислоты или щелочи. Если реакция происходит с образованием соли и воды, то оксид является амфотерным.
Третий способ – использование реакции оксида с раствором аммиака. Если образуется осадок, то оксид является кислотой. Если раствор окрасится в розовый цвет, то оксид является основанием. Если не происходит ни образования осадка, ни окрашивания раствора, то оксид является нейтральным.
Правила определения амфотерных оксидов

- Амфотерные оксиды обладают способностью взаимодействовать как с кислотами, так и с щелочами.
- Для определения амфотерного оксида необходимо обратить внимание на его химическую формулу.
- Амфотерные оксиды часто содержат как положительные, так и отрицательные ионы в своей структуре.
- Чтобы определить, является ли оксид амфотерным, можно использовать простые эксперименты, включая реакцию с кислотой и щелочью.
- Если оксид реагирует как с кислотой, так и с щелочью, то это является признаком его амфотерности.
- Примером амфотерного оксида является оксид алюминия (Al2O3), который реагирует как с кислотой, так и с щелочью.
Применение амфотерных оксидов в промышленности

Одним из основных применений амфотерных оксидов является их использование в качестве катализаторов. Они способны ускорять химические реакции и повышать эффективность процессов, протекающих на производстве. Благодаря этому, их широко применяют в производстве красителей, пластиков, фармацевтических препаратов и многих других химических продуктов.
Амфотерные оксиды также используются в электроэнергетике. Они являются основными компонентами электролитов для аккумуляторных батарей. Это позволяет достичь высокой производительности и длительного срока службы батарей, что является важным фактором в различных областях, включая автотранспорт и телекоммуникации.
Еще одним областью применения амфотерных оксидов является производство стекла и керамики. Они добавляются в составы стекловидных материалов для придания им требуемых свойств, таких как прозрачность, тепло- и химическая стойкость. Они также позволяют контролировать температуру плавления и улучшить прочностные характеристики готовых изделий.
Кроме того, амфотерные оксиды применяются в процессе очистки воды. Они способны образовывать химические соединения с различными загрязнителями, такими как тяжелые металлы, ионные соединения и органические вещества. Благодаря этому, они помогают улучшить качество питьевой воды и защищать окружающую среду от загрязнений.
Роль амфотерных оксидов в экологии
В экологии амфотерные оксиды играют значительную роль в нейтрализации кислотных и щелочных веществ. Они могут служить своеобразными "поглотителями" кислотных и щелочных компонентов, помогая поддерживать баланс рН в водных системах.
Также амфотерные оксиды могут взаимодействовать с различными элементами и соединениями, что способствует образованию минеральных соединений и стабилизации их концентрации в природных системах.
Благодаря своему уникальному свойству проявлять как кислотные, так и щелочные свойства, амфотерные оксиды способны влиять на химические процессы в природной среде и обеспечивать ее стабильность и устойчивость.