Прямая реакция происходит, когда реагенты взаимодействуют и превращаются в продукты. Этот процесс может происходить с различной скоростью. Ускорение или замедление прямой реакции может быть обусловлено различными факторами, включая температуру, концентрацию реагентов и наличие катализаторов.
Обратная реакция - это обратный процесс, в результате которого продукты превращаются обратно в реагенты. Обычно прямая и обратная реакции происходят параллельно, пока система не достигнет равновесия. Скорость обратной реакции также может изменяться под влиянием различных факторов.
Понимание причин и факторов, влияющих на скорость прямых и обратных реакций, является важным для разработки новых материалов, улучшения технологических процессов и оптимизации производственных цепей. Дальнейшие исследования в этой области помогут расширить наши знания о химических реакциях и повысить нашу способность контролировать их поток.
Прямая реакция: что это, скорость

Скорость прямой реакции может быть определена как изменение концентрации реакционных веществ в единицу времени. Скорость реакции может зависеть от различных факторов, таких как концентрация веществ, температура, присутствие катализаторов и поверхность контакта реакционных веществ.
Прямая реакция может быть мгновенной или может занимать продолжительное время. Например, взрывы происходят в результате мгновенной прямой реакции, в то время как в других случаях реакция может занимать дни или даже годы.
Скорость прямой реакции может быть увеличена путем повышения концентрации реакционных веществ, увеличения температуры или применения катализаторов. Эти факторы способствуют более частым столкновениям молекул, что ускоряет протекание реакции.
Определение скорости прямой реакции является важным аспектом изучения химических реакций. Это позволяет уточнять кинетические параметры реакций и исследовать влияние различных факторов на скорость и направленность протекания реакции.
Что такое прямая реакция
| Свойства прямой реакции | Примеры |
|---|---|
| Скорость | Прямая реакция может происходить с разной скоростью в зависимости от условий, таких как температура, концентрация реагентов или наличие катализаторов. |
| Причины | Прямая реакция происходит из-за взаимодействия реагентов, которое приводит к образованию новых связей и образованию продуктов реакции. |
| Факторы | Прямую реакцию могут повысить или замедлить различные факторы, такие как повышение или понижение температуры, изменение концентрации реагентов или использование катализаторов. |
Прямая реакция является основной частью многих химических процессов и имеет важное значение в области науки и промышленности. Понимание принципов и свойств прямой реакции помогает ученым и инженерам улучшать и оптимизировать производственные процессы, разрабатывать новые материалы и продукты, а также предсказывать и объяснять результаты химических реакций.
Как скорость влияет на прямую реакцию

Скорость играет важную роль в прямой реакции, определяя ее эффективность и эффективность выполнения задачи. Быстрая реакция может способствовать большей точности, улучшению производительности и более высокому уровню выполнения задачи.
1. Ускорение принятия решений
Высокая скорость реакции поможет принимать решения быстрее, что особенно важно в ситуациях, требующих немедленного ответа. Например, в спорте быстрая реакция может помочь спортсмену увернуться от опасности или сделать решающий ход в решающий момент.
2. Улучшенная координация движений
Скорость также влияет на координацию движений, что позволяет более эффективно выполнять физические действия. Высокая скорость реакции позволяет более точно регулировать мускульное напряжение и контролировать движения, что в свою очередь может повысить точность и уменьшить вероятность ошибок.
3. Более быстрая реализация задачи
Повышенная скорость реакции может способствовать более быстрому выполнению задачи. Например, при управлении транспортным средством, быстрая реакция может помочь водителю быстро избежать опасных ситуаций на дороге или принять необходимые маневры для предотвращения катастроф.
В целом, скорость является важным фактором, влияющим на прямую реакцию. Быстрая реакция может помочь улучшить решение и выполнение задачи, а также повысить эффективность и производительность в различных ситуациях.
Причины прямой реакции
| Причина | Объяснение |
|---|---|
| Возрастание концентрации реагентов | Чем выше концентрация реагентов, тем больше вероятность их столкновения и возможность протекания прямой реакции. Повышение концентрации может быть обусловлено добавлением большего количества реагентов или понижением объема реакционной смеси. |
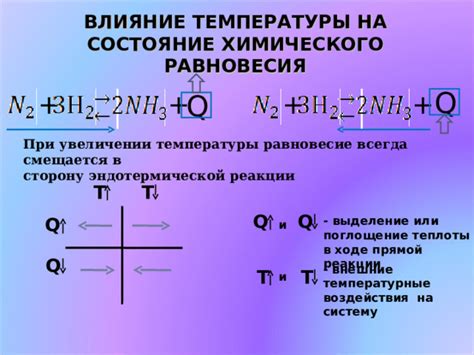
| Повышение температуры | Увеличение температуры обычно увеличивает скорость молекулярных движений реагентов, что приводит к частым столкновениям и, следовательно, к большей вероятности прямой реакции. |
| Приготовление продуктов | Некоторые реакции не могут протекать, если один или несколько продуктов уже присутствуют в реакционной смеси. При удалении продуктов из системы или их потреблении, может начаться прямая реакция. |
| Использование катализатора | Катализаторы могут повысить скорость химической реакции, облегчить протекание прямой реакции и снизить энергию активации. Они обычно участвуют в реакции, но остаются неизменными после ее завершения. |
Это лишь некоторые из возможных причин, которые могут способствовать протеканию прямой реакции. Каждая реакция уникальна и может иметь свои особенности и факторы, влияющие на ее ход.
Обратная реакция: что это, скорость

Скорость обратной реакции зависит от нескольких факторов. Во-первых, концентрация реагентов играет важную роль. Чем выше концентрация реагентов, тем быстрее будет протекать обратная реакция. Во-вторых, температура также влияет на скорость обратной реакции. При повышении температуры скорость обратной реакции увеличивается, так как реакция становится более энергетически выгодной.
Другим фактором, влияющим на скорость обратной реакции, является катализатор. Катализаторы ускоряют процесс обратной реакции, облегчая переход реагентов в продукты. Они снижают энергию активации, необходимую для возникновения обратной реакции.
Что такое обратная реакция
Обратная реакция характеризуется скоростью процесса, направленного в обратном направлении прямой реакции. Она может быть вызвана различными причинами, включая изменение концентрации реагентов или давления, изменение температуры или использование катализаторов.
Во время обратной реакции продукты реакции становятся реагентами и реагенты превращаются в продукты. Скорость обратной реакции может быть разной и зависеть от различных факторов, таких как концентрация реагентов, температура, давление и наличие катализаторов.
Изучение обратной реакции позволяет лучше понять, как химические процессы достигают равновесия и как они могут быть контролируемы. Реакции в обоих направлениях играют важную роль в различных процессах, включая промышленность, биологию и окружающую среду.
Как скорость влияет на обратную реакцию

При увеличении скорости реакции происходит ускорение обратной реакции. Это может быть полезно, если нужно достичь равновесия в системе быстрее. Например, в химических реакциях, где происходит обратная реакция, увеличение скорости может быть полезным для уменьшения времени, необходимого для достижения равновесия.
Однако слишком высокая скорость реакции может привести к неожиданным последствиям. В некоторых случаях, слишком быстрая обратная реакция может стать проблемой. Например, в биологических системах, ускорение обратной реакции может привести к нежелательным эффектам или даже к возникновению заболеваний.
Поэтому при изучении обратной реакции важно учитывать скорость реакции и находить баланс между быстрым достижением равновесия и нежелательными последствиями, которые могут возникнуть в результате слишком быстрой обратной реакции.
В целом, скорость реакции имеет большое значение и влияет на обратную реакцию. Оптимальная скорость реакции позволяет достичь равновесия системы, учитывая потенциальные риски, связанные с слишком быстрой обратной реакцией.
Факторы, влияющие на обратную реакцию
Концентрация веществ: Концентрация веществ также влияет на обратную реакцию. Если концентрация реагентов увеличивается, то скорость обратной реакции увеличивается, а если концентрация уменьшается, то скорость обратной реакции уменьшается.
Давление: Давление также может оказывать влияние на обратную реакцию. Например, при увеличении давления можно увеличить скорость обратной реакции.
Катализаторы: Использование катализаторов может сильно повлиять на скорость обратной реакции. Катализаторы способны ускорить протекание обратной реакции, предоставляя альтернативные пути реакции.
Распределение частиц: Распределение частиц также оказывает влияние на скорость обратной реакции. Если частицы находятся в одной фазе и равномерно распределены, то обратная реакция может протекать быстрее.
Присутствие ингибиторов: Ингибиторы, наоборот, замедляют обратную реакцию, предотвращая взаимодействие реагентов.
Энергия активации: Энергия активации представляет собой энергию, необходимую для протекания обратной реакции. Чем ниже энергия активации, тем быстрее протекает обратная реакция.
Все эти факторы оказывают влияние на скорость обратной реакции и могут быть использованы для ее регулирования и контроля.