Раствор KH2PO4 – это одно из важных соединений в химии, обладающее рядом особых свойств. В чистом виде KH2PO4 представляет собой бесцветные кристаллы, которые хорошо растворяются в воде. Получаемый раствор обладает слабокислыми свойствами, что делает его полезным инструментом в различных областях.
Одной из причин, почему раствор KH2PO4 обусловливает слабокислую среду, является наличие фосфорной кислоты (H3PO4) в его составе. Взаимодействуя с водой, молекулы этого соединения образуют ионы водорода (H+), которые и являются источником кислотности раствора. Присутствие фосфорной кислоты делает раствор KH2PO4 кислотным, но при этом не настолько сильным, чтобы вызывать раздражение или коррозию.
Второй важной причиной слабокислого характера раствора KH2PO4 является его буферная способность. Буферные растворы обладают способностью поддерживать постоянный уровень кислотности или щелочности при добавлении кислотных или щелочных веществ. KH2PO4, как буферный раствор, может поддерживать константное pH в определенном диапазоне, сдерживая резкое изменение уровня кислотности, что особенно полезно в лабораторной практике и в различных химических процессах.
Итак, раствор KH2PO4 – это многоцелевое соединение, обладающее слабокислыми свойствами, благодаря наличию фосфорной кислоты и способности к буферизации. Его использование в химической, медицинской и других сферах делает его незаменимым компонентом множества процессов и реакций.
Раствор KH2PO4: тайны слабокислого окружения
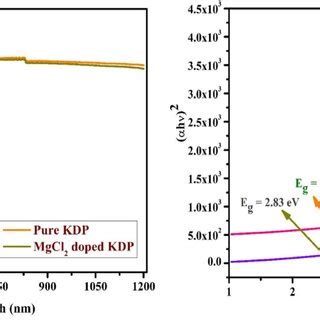
Раствор KH2PO4 относится к слабокислым средам из-за своей химической природы. Это солевой состав, включающий кристаллы калия, водорода и фосфата. Возможность образования водородной ионы (H+) в растворе придаёт ему слабокислый характер.
Одной из причин слабой кислотности раствора KH2PO4 является его авторегулирующая способность. При добавлении щелочи, например NaOH, в раствор, происходит образование водной среды, основанный на реакции:
NaOH + H2O → Na+ + OH- + H2O
Гидроксид ион (OH-) обладает базическим потенциалом и реагирует с ионом фосфорной кислоты (H2PO4-) в растворе KH2PO4:
H2PO4- + OH- → HPO42- + H2O
Такие реакции переносят ионный баланс к ионам фосфора (HPO42-) и уменьшают концентрацию ионов водорода. Этот процесс позволяет раствору KH2PO4 сохранять слабокислую среду даже при добавлении щелочи.
Также, слабая кислотность раствора KH2PO4 может быть объяснена наличием ионов калия (K+) в составе. Ионы калия реагируют с водой и могут увеличивать pH раствора:
K+ + H2O → KOH + H+
Однако, в растворе KH2PO4 калиевые ионы оказывают сопротивление изменениями pH, из-за возможности реагировать с фосфатными и гидроксидными ионами.
Всё вышесказанное объясняет, почему раствор KH2PO4 имеет слабокислую среду. Это явление имеет важное применение в различных процессах, включая пищевые промышленности, фармацевтику и аналитическую химию.
Почему раствор KH2PO4 считается слабокислым?

Раствор KH2PO4 считается слабокислым из-за его способности донорства протона в водной среде. В молекуле KH2PO4 присутствуют две молекулы водорода (H), которые могут отдавать свои протоны (H+) в растворе. Эти протоны считаются кислотными, и их концентрация определяет кислотность раствора.
Также в составе молекулы KH2PO4 присутствует атом фосфора (P), который может образовывать кислотные и основные группы. В данном случае, атом фосфора образует кислотную группу, поскольку он способен принять пару электронов и образовывать ковалентную связь с другой молекулой или атомом.
Комбинация кислотных групп в молекуле KH2PO4 и их способность отдавать протоны, делает раствор KH2PO4 слабокислым. Это значит, что концентрация ионов H+ в растворе KH2PO4 невелика в сравнении с сильными кислотами, такими как HCl.
Важно отметить, что степень кислотности раствора KH2PO4 может изменяться в зависимости от его концентрации и условий окружающей среды. Однако, в обычных условиях раствор KH2PO4 считается слабокислым и может быть использован в лабораторных и промышленных процессах, требующих слабокислой среды.
Химическое соединение KH2PO4: особенности и свойства
Основные особенности и свойства KH2PO4:
- KH2PO4 обладает слабокислыми свойствами и может выступать как слабый донор протона. Это свойство делает его полезным в качестве буферного раствора в различных химических и биологических приложениях.
- Присутствие калия делает KH2PO4 солевым соединением, что обеспечивает его растворимость в воде и других полных поляризующих растворителях.
- KH2PO4 образует прозрачные кристаллы, которые хорошо растворяются в воде, образуя прозрачный раствор. Это делает его удобным для использования в лабораторных экспериментах и процессах смешивания.
- Однако, при нагревании KH2PO4 может разложиться, образуя фосфаты более высоких валентностей. Этот процесс может использоваться для получения других фосфатных соединений.
- Температурный интервал плавления KH2PO4 составляет около 253-255°С, в зависимости от чистоты материала. При этой температуре он tansforms в аморфную форму.
- KH2PO4 также может быть использован в качестве первичного и вторичного стандарта для pH-измерений.
- Дигидрофосфат калия имеет широкий спектр применений, включая использование в пищевой промышленности, производстве удобрений, фармацевтической промышленности и процессах очистки воды.
В целом, KH2PO4 является важным соединением, которое обладает рядом уникальных свойств и часто используется в различных отраслях промышленности и научных исследованиях.
Роль KH2PO4 в биохимических процессах

Во-вторых, KH2PO4 используется в качестве источника фосфора для синтеза нуклеиновых кислот - ДНК и РНК. Фосфор является неотъемлемой частью нуклеотидов, основных строительных блоков нуклеиновых кислот. Благодаря наличию KH2PO4 в клетке, она может синтезировать достаточное количество нуклеотидов для обеспечения своих репродуктивных и генетических функций.
Кроме того, KH2PO4 играет важную роль в энергетическом обмене клетки. Он является ключевым компонентом фосфорилации, процесса, который позволяет клеткам производить энергию в форме АТФ (аденозинтрифосфата). АТФ является основным источником энергии для всех клеточных процессов, включая сокращение мышц, синтез белков и дренаж тепла из организма.
Таким образом, KH2PO4 имеет не только роль в поддержании слабокислой среды, но и играет важную роль во многих биохимических процессах, обеспечивая нормальное функционирование клеток. Это делает его необходимым компонентом среды для многих биологических и медицинских исследований.
Влияние раствора KH2PO4 на окружающую среду

Раствор KH2PO4, известный также как моноаммонийфосфат, имеет слабокислую среду, что оказывает влияние на окружающую среду.
1. Воздействие на почву
При использовании раствора KH2PO4 в сельском хозяйстве и садоводстве он попадает в почву. Он может повлиять на pH-уровень почвы, сделав ее более кислотной. Это может отрицательно сказаться на росте растений, так как многие культуры предпочитают нейтральную или слабощелочную среду.
2. Влияние на воду и водные экосистемы
Если раствор KH2PO4 попадает в воду, он может также повлиять на pH-уровень. Изменение pH-уровня в водоемах может оказать негативное влияние на различные водные организмы. Кислая среда может привести к гибели рыб и других водных животных, а также нарушить экологическое равновесие.
3. Воздействие на атмосферу
При применении раствора KH2PO4 в аграрной сфере могут возникать испарения и пыль, которые попадают в атмосферу. Это может вызвать заметное изменение ее химического состава и привести к загрязнению воздуха. Кислотные испарения, в свою очередь, могут оказывать раздражающее действие на легкие и дыхательные пути человека.
В целом, необходимо помнить о влиянии раствора KH2PO4 на окружающую среду и применять его осторожно, чтобы минимизировать его негативное воздействие.
Применение KH2PO4 в промышленности и научных исследованиях
Раствор KH2PO4, иначе известный как фосфорная кислота, находит широкое применение в промышленности и научных исследованиях благодаря своим уникальным свойствам и химическому составу.
Одним из основных применений KH2PO4 является его использование в процессе производства удобрений. Фосфор, содержащийся в растворе, является важным питательным элементом для растений, поэтому фосфорные удобрения на основе KH2PO4 способствуют улучшению роста и развития растений, а также увеличению урожая.
Кроме того, KH2PO4 применяется в качестве регулятора кислотности в пищевой и фармацевтической промышленности. Благодаря своим слабым кислотным свойствам, раствор KH2PO4 используется для корректировки pH значений в различных продуктах, таких как мясные изделия, пиво, сыр и многие другие. Кроме того, KH2PO4 применяется в производстве лекарственных препаратов, благодаря своим антиоксидантным и противомикробным свойствам.
В научных исследованиях KH2PO4 используется как компонент в различных химических реакциях, таких как синтез органических соединений и определение содержания фосфатов в различных образцах. Также KH2PO4 может использоваться в качестве буфера при проведении различных экспериментов, так как его pH свойства позволяют максимально стабилизировать среду и предотвратить изменение pH значений.
Безопасность и последствия использования раствора KH2PO4

В целом, раствор KH2PO4 считается безопасным для использования, однако, как и в случае с любым химическим веществом, необходимо принимать определенные меры предосторожности.
При работе с раствором KH2PO4 следует носить защитные очки, рукавицы и другое средство индивидуальной защиты, чтобы избежать попадания вещества на кожу, слизистые оболочки и глаза. В случае контакта с кожей или глазами, необходимо немедленно промыть большим количеством воды и обратиться за медицинской помощью.
Не рекомендуется инициировать реакции, которые могут привести к образованию опасных продуктов, таких как дымы или пары. Кроме того, раствор KH2PO4 не стоит нагревать выше определенной температуры, чтобы избежать возможных взрывов или аварийных ситуаций.
Важно хранить раствор KH2PO4 в надлежащих условиях, вдали от прямого солнечного света, влаги и источников тепла. Это поможет предотвратить разложение и ухудшение качества раствора. Также, не стоит хранить раствор вблизи других химических веществ, чтобы избежать возможных реакций или контаминации.
В случае случайного попадания раствора KH2PO4 в организм, необходимо проконсультироваться с врачом для получения соответствующей медицинской помощи и рекомендаций.
В целом, соблюдение всех необходимых мер предосторожности и правил безопасного обращения с раствором KH2PO4 во время его использования поможет минимизировать риск возникновения негативных последствий и обеспечит безопасность оператора и окружающей среды.