Соляная кислота – это одна из самых распространенных и важных минеральных кислот в химии. Она активно используется в различных отраслях народного хозяйства, начиная от производства удобрений и заканчивая использованием в медицине. Различные химические реакции соляной кислоты вызывают большой интерес среди ученых, а одной из наиболее изученных является ее реакция с оксидами металлов, в частности, с CaO.
Растворение соляной кислоты в CaO представляет собой сильно экзотермическую реакцию, сопровождающуюся выделением большого количества тепла. Основным механизмом этого процесса является протекание обратимого химического взаимодействия между CaO и HCl с образованием хлорида кальция (CaCl2) и воды (H2O). Реакция сопровождается выделением большого количества тепла, что позволяет использовать ее для нагревания веществ или получения энергии.
Растворение соляной кислоты в CaO происходит при определенных условиях, которые обеспечивают максимальное протекание реакции. Во-первых, важно поддерживать достаточно высокую концентрацию и температуру реагирующих веществ. Чем выше концентрация соляной кислоты и температура, тем быстрее и полнее протекает реакция. Во-вторых, влияние имеют размер и состояние частиц CaO. Чем больше поверхность частиц и чем более их состояние дисперсное, тем интенсивнее происходит растворение кислоты.
Механизм реакции растворения соляной кислоты в CaO
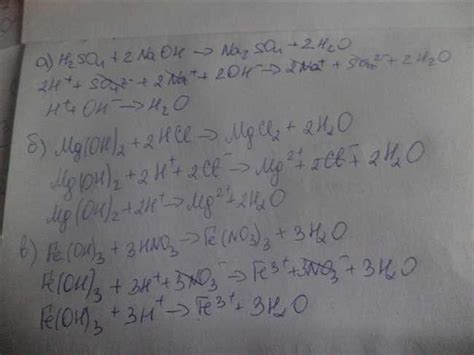
Механизм реакции
Растворение соляной кислоты (HCl) в оксиде кальция (CaO) происходит в несколько этапов. Вначале происходит диссоциация молекул HCl, в результате которой образуются ион H+ и ион Cl-. Затем ионы H+ взаимодействуют с поверхностью CaO, приводя к образованию оксоанионов HCO3- и Cl-. В конце концов, оксоанионы HCO3- превращаются в гидрокарбонатные ионы HCO3-.
Условия проведения
Реакция растворения HCl в CaO может протекать при комнатной температуре. Однако, повышение температуры может ускорить процесс растворения. Также важным фактором является концентрация HCl. Чем выше концентрация, тем более интенсивно происходит реакция растворения. При этом стоит отметить, что уровень растворенного CaO будет пропорционален концентрации HCl.
Роль CaO
Оксид кальция (CaO) играет важную роль в реакции растворения соляной кислоты (HCl). Он является щелочным оксидом и обладает высокой основностью. CaO реагирует с ионами H+ из HCl, образуя оксоанионы HCO3-. Таким образом, CaO не только улучшает скорость реакции, но и участвует в образовании ионов HCO3-, которые могут быть использованы в других химических процессах.
Влияние условий на реакцию растворения соляной кислоты в CaO

Первым и наиболее важным фактором является концентрация соляной кислоты. Чем выше концентрация кислоты, тем быстрее и интенсивнее будет протекать процесс растворения. Однако стоит отметить, что кислота слишком концентрированная может вызвать более интенсивное образование газов, что может привести к всплескам и потере части реакционной смеси.
Еще одним фактором, влияющим на ход реакции растворения, является температура. Увеличение температуры ускоряет кинетику реакции и способствует повышению конверсии соляной кислоты. Это связано с тем, что при повышении температуры молекулы становятся более подвижными и активными, что улучшает контакт между реагентами.
Однако, следует отметить, что при слишком высокой температуре может происходить испарение соляной кислоты, что приводит к потере реагента и снижению эффективности реакции. Поэтому, необходимо подобрать оптимальную температуру, чтобы достичь максимального выхода продукта при минимальных потерях.
Кроме того, влияние оказывает также объем реакционной смеси и скорость перемешивания. Увеличение объема смеси обычно приводит к увеличению конверсии, так как увеличивается площадь контакта между реагентами. При этом, скорость перемешивания играет роль в обеспечении равномерного распределения кислоты и обратным растворением продукта.
Итак, для эффективного растворения соляной кислоты в CaO необходимо учитывать концентрацию кислоты, температуру, объем смеси и скорость перемешивания. Оптимальные условия можно подобрать экспериментальным путем, чтобы обеспечить максимальный выход продукта и максимальную эффективность реакции.
Влияние температуры на реакцию растворения соляной кислоты в CaO

При повышении температуры растворение соляной кислоты происходит более интенсивно, поскольку повышение температуры обеспечивает более высокую энергию молекул, увеличивая скорость реакции. Это приводит к быстрому расщеплению молекул соляной кислоты и образованию ионов H+.
Также следует отметить, что повышение температуры способствует увеличению теплового движения молекул вещества, что в свою очередь увеличивает степень их взаимодействия и улучшает процесс растворения. Более высокая температура также способствует увеличению концентрации реагентов в растворе, что увеличивает вероятность их взаимодействия и ускоряет реакцию.
Однако следует отметить, что с повышением температуры может возникать и обратная реакция - кристаллизация соли. Поэтому для эффективного растворения соляной кислоты в CaO оптимальная температура должна быть выбрана с учетом этих факторов.
Роль концентрации соляной кислоты при реакции растворения в CaO

Соляная кислота (HCl) реагирует с оксидом кальция (CaO) в соотношении 1:1, образуя хлорид кальция (CaCl2) и воду (H2O).
Увеличение концентрации HCl увеличивает скорость реакции растворения в CaO и количество образующихся продуктов. Высокая концентрация HCl создает большое количество активных частиц, способствуя большему количеству столкновений и ускоряя процесс реакции.
Однако, слишком высокая концентрация HCl может привести к обратной реакции, при которой CaCl2 реагирует с водой, образуя CaO и HCl. Также, высокая концентрация HCl может привести к поглощению большого количества тепла и увеличению температуры реакционной смеси.
Следовательно, важно подбирать оптимальную концентрацию соляной кислоты для реакции растворения в CaO с учетом требуемой скорости реакции и образования продуктов.
Влияние размера частиц CaO на процесс растворения соляной кислоты
Размер частиц CaO играет важную роль в процессе растворения соляной кислоты. Более мелкие частицы CaO обладают большей реакционной поверхностью, что способствует увеличению скорости растворения.
При взаимодействии между частицами CaO и соляной кислотой, происходит следующая реакция:
CaO + 2HCl → CaCl2 + H2O
Мелкие частицы CaO обеспечивают большую область контакта с молекулами соляной кислоты, что позволяет большему количеству реагирующих частиц участвовать в реакции одновременно. Это приводит к увеличению скорости реакции и более быстрому растворению CaO в соляной кислоте.
Важно отметить, что качество CaO также оказывает влияние на процесс растворения. Чистые и хорошо очищенные частицы CaO обеспечивают более эффективное растворение и меньшее количество побочных продуктов реакции.
Однако, при использовании слишком мелких частиц CaO слишком высокая реакционная поверхность может привести к проблемам, таким как агломерация и слипание частиц. Это может замедлить процесс растворения и снизить эффективность реакции.
Таким образом, оптимальный размер частиц CaO должен обеспечивать достаточно большую реакционную поверхность для эффективного растворения соляной кислоты, но при этом не вызывать проблем с агломерацией и слипанием частиц.
Влияние времени взаимодействия на продуктивность реакции

При слишком коротком времени взаимодействия, реакция может не протекать полностью, и часть соляной кислоты остается неиспользованной. Это связано с нехваткой времени для полного проникновения соляной кислоты в структуру CaO и активации реакции. В результате, переход распавшегося CaO в новые растворимые фазы может оказаться недостаточным.
С другой стороны, слишком длительное время взаимодействия может привести к нежелательным побочным реакциям и деградации продуктов. Постоянная экспозиция соляной кислоты к CaO может привести к образованию нерастворимых отложений или термическому разложению продуктов реакции.
Для достижения оптимальной продуктивности реакции растворения соляной кислоты в CaO, необходимо проводить эксперименты при различных временах взаимодействия и определять выход раствора и качество получаемых продуктов. Оптимальное время взаимодействия может зависеть от конкретных условий эксперимента, таких как температура, концентрация соляной кислоты и размер частиц CaO.
Отклонения от идеального механизма при растворении соляной кислоты в CaO
Растворение соляной кислоты в CaO обычно происходит по идеальному механизму, где CaO реагирует с HCl, образуя CaCl2 и H2O:
- Сначала идет диссоциация молекул соляной кислоты на ионы водорода и хлора.
- Затем ионы водорода привлекаются к поверхности CaO благодаря его высокой активности и образуют кислотный протон с поверхностью оксида кальция.
- Кислотный протон освобождается от поверхности оксида кальция и соединяется с ионом хлора, образуя молекулу HCl.
- Образовавшийся CaCl2 остается на поверхности CaO или диссоциирует, если реакция происходит в растворе.
Однако, иногда обнаруживаются отклонения от этого идеального механизма. Они могут быть вызваны различными факторами, такими как:
- Наличие примесей в CaO, которые могут изменять его активность и поверхностные свойства, влияя на реакцию.
- Окисление CaO при контакте с воздухом, что может привести к образованию сложных оксидов и влиять на реакцию.
- Изменение температуры или концентрации реагентов, что может изменить скорость реакции и механизм.
Понимание этих отклонений от идеального механизма растворения соляной кислоты в CaO является важным для оптимизации процесса и контроля его эффективности. Кроме того, изучение этих отклонений может привести к разработке новых подходов и катализаторов для растворения соляной кислоты и других химических реакций.
Практическое применение реакции растворения соляной кислоты в CaO
Реакция растворения соляной кислоты в CaO имеет широкое практическое применение в различных отраслях науки и промышленности. Ниже представлены несколько областей, где используется данная реакция.
1. Производство хлорида кальция:
При взаимодействии соляной кислоты с CaO образуется хлорид кальция (CaCl₂), который применяется в многих промышленных процессах. Хлорид кальция используется в производстве пищевых добавок, в ледогенераторах, в медицине, а также в качестве дегидратационного средства и противогололедного вещества.
2. Очистка газовых выбросов:
Реакция растворения соляной кислоты в CaO может использоваться для очистки газовых выбросов от примесей и загрязнителей. Кальций, образующийся при реакции, обладает адсорбционными свойствами и способен удалять из газовых потоков серу, оксиды азота и другие вредные вещества.
3. Водоподготовка:
Реакция растворения соляной кислоты в CaO может применяться для очистки воды от железа, соединений серы и других минеральных примесей. Кальций, образующийся при реакции, осаждает эти примеси в виде твердых частиц, которые затем могут быть удалены с помощью фильтров и осадков.
В итоге, реакция растворения соляной кислоты в CaO является важным процессом, который находит свое применение в различных областях промышленности и научных исследований.