Водород – самый легкий элемент в периодической системе химических элементов, обладающий особыми свойствами. Его активность, высока электроотрицательность и способность образовывать соединения с различными элементами делают его важным участником множества реакций.
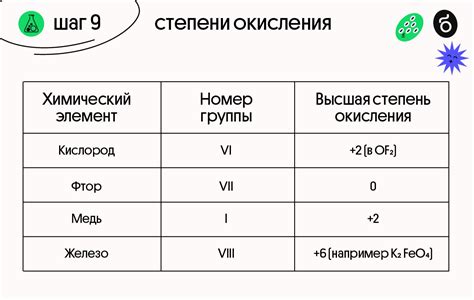
Одним из ключевых понятий в химии является степень окисления элемента. Степень окисления позволяет определить, сколько электронов элемент потерял или приобрел в реакции. В случае водорода, степень окисления может быть как положительной, так и отрицательной.
Отрицательная степень окисления водорода имеет огромное значение в химических реакциях. Водород со степенью окисления -1 встречается во многих соединениях, таких как гидриды металлов и ковалентные соединения. В гидридах металлов, водород под действием ионной связи тесно связан с металлическим атомом, образуя сильные и стабильные соединения.
Кроме того, отрицательная степень окисления водорода позволяет использовать его важное свойство – способность к каталитическому действию. Водород, обладая отрицательной степенью окисления, может участвовать в реакциях восстановления, облегчая процесс и ускоряя химическую реакцию. Такое каталитическое действие водорода позволяет применять его в различных промышленных процессах, в производстве горючих веществ и водородных топливных элементов.
Роль и значение отрицательной степени окисления водорода
Отрицательная степень окисления водорода указывает на наличие лишних электронов в атоме водорода. Это свойство делает его сверхактивным и способным к агрессивной реакции с другими веществами. H- способен выступать в качестве сильного восстановителя и сильного основания, и его наличие может существенно изменить химическое поведение соединения.
Одним из примеров, где отрицательная степень окисления водорода имеет важное значение, является гидридное соединение. Гидриды представляют собой химические соединения, где водород является восстановителем. Они широко используются в промышленности и лабораторных условиях как агенты восстановления и катализаторы в различных реакциях.
Отрицательная степень окисления водорода также может быть связана с его важным участием в биохимических процессах. В организме живых существ водород с отрицательной степенью окисления играет роль в водородных связях, которые являются основой для структуры и функции белков, нуклеиновых кислот и других биомолекул.
Таким образом, отрицательная степень окисления водорода имеет значительное значение в химии, особенно в контексте его химической активности и участия в различных реакциях. Изучение и понимание этой роли помогают расширить наши знания о химических процессах и их применении в разных областях, включая промышленность и биохимию.
Химические реакции и свойства
Отрицательная степень окисления водорода играет важную роль во многих химических реакциях и обладает рядом уникальных свойств.
1. Реактивность: Вещества с отрицательным степенями окисления водорода обычно являются хорошими восстановителями и химическими реагентами. Они обладают высокими энергетическими свойствами и способны активно участвовать в реакциях с окислителями, передавая свои электроны.
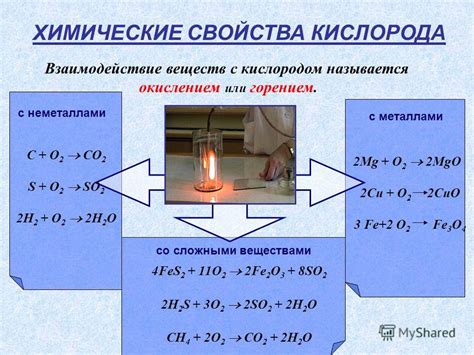
2. Кислотность: Вещества с отрицательным степенями окисления водорода могут образовывать кислоты. Например, многие соединения с отрицательным степенями окисления водорода, такие как водородные сульфиды (H2S) или водородные хлориды (HCl), образуют кислотные растворы при диссоциации в воде. Эти кислоты имеют важное значение в различных индустриальных процессах и могут использоваться в химическом анализе.
3. Формирование связей: Молекулы с отрицательным степенями окисления водорода могут образовывать особые типы химических связей, например, водородные связи. Водородные связи имеют большое значение в биологических системах и являются основой многих биологических процессов.
4. Физические свойства: Вещества с отрицательным степенями окисления водорода обычно обладают характеристиками, такими как низкая плотность, высокая температура кипения и растворимость в воде. Эти свойства делают их широко используемыми в различных отраслях промышленности, таких как производство пластмасс и производство удобрений.
5. Взаимодействие с металлами: Вещества с отрицательным степенями окисления водорода могут образовывать соединения с металлами, обладающие интересными свойствами. Например, металлы могут образовывать гидриды с водородом, которые могут использоваться в различных технологических процессах, таких как производство металлургических материалов или производство электродов для аккумуляторов.
Участие в различных реакциях
Водаород в отрицательном степени окисления широко участвует в различных реакциях. Его способность существовать в форме ионов с отрицательным зарядом позволяет использовать его в качестве сильного редукционного агента.
Одной из наиболее известных реакций, в которых отрицательная степень окисления водорода принимает активное участие, является электролиз. В процессе электролиза вода разлагается на кислород и водород, причем водород выделяется на отрицательном электроде. Эта реакция является важным способом производства водорода.
Отрицательная степень окисления водорода также играет ключевую роль в реакциях горения. При сгорании водорода образуется вода, а энергия, которая выделяется в данном процессе, используется в различных отраслях промышленности.
Кроме того, отрицательный водород может быть использован в качестве сильного редукционного агента. Он может восстанавливать другие элементы, переходя сам в более высокую степень окисления. Это свойство отрицательного водорода можно применять в синтезе различных соединений и органических реакциях.
Использование в промышленности и научных исследованиях

Отрицательная степень окисления водорода имеет широкое применение в различных областях промышленности и научных исследованиях.
В промышленности отрицательная степень окисления водорода используется для производства различных химических веществ. Например, эта технология широко применяется в производстве аммиака, водорода и металлов. В процессе выпуска аммиака при помощи отрицательной степени окисления водорода можно получить высокоочищенный продукт.
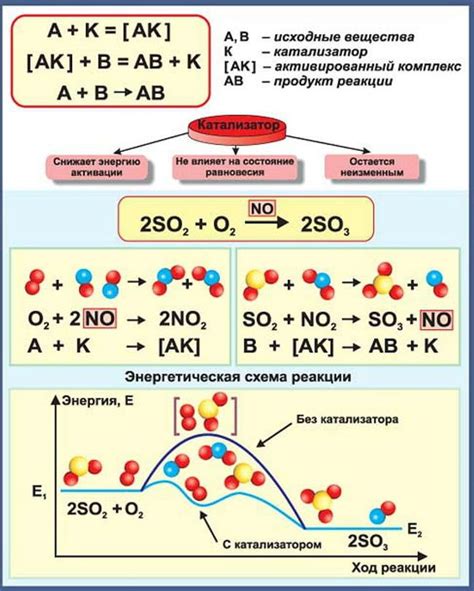
Также, отрицательная степень окисления водорода нашла применение в процессе исследования катализаторов. Изучая взаимодействие катализаторов с отрицательно заряженными водородными ионами, ученые могут более глубоко понять структуру и свойства катализаторов, что помогает разрабатывать более эффективные процессы катализа.
Отрицательная степень окисления водорода также играет важную роль в исследовании электрохимических систем. Изучая уровень окисления и редукции водорода, ученые получают информацию о потенциале системы и могут предсказать ее электрохимические свойства.
Таким образом, использование отрицательной степени окисления водорода в промышленности и научных исследованиях имеет большое значение. Оно позволяет получать высокопрочные и очищенные продукты, изучать структуру и свойства катализаторов, а также предсказывать электрохимические свойства систем.
Главные источники и способы получения

Отрицательные степени окисления водорода можно получить из различных источников. Некоторые из них включают:
1. Разложение органических веществ: Процесс разложения органических веществ может привести к образованию отрицательных степеней окисления водорода. Например, при нагревании кислородсодержащих соединений, таких как пероксиды и супероксиды, могут образовываться отрицательные степени окисления водорода.
2. Электролиз: Электролиз воды является одним из основных способов получения отрицательных степеней окисления водорода. При этом процессе вода разлагается на атомы водорода и кислород под действием электрического тока. Отрицательные степени окисления водорода образуются на катоде.
3. Реакции с веществами, обладающими отрицательным окислением: В некоторых химических реакциях водород может образовывать отрицательные степени окисления в реакции с веществами, обладающими отрицательным окислением. Например, при реакции с металлами группы 1 водород образует отрицательные степени окисления.
4. Фотохимические реакции: Внешнее воздействие, такое как свет, может приводить к образованию отрицательных степеней окисления водорода в некоторых фотохимических реакциях. Например, при фотолизе воды под действием солнечного света может образовываться отрицательный водород.
Знание главных источников и способов получения отрицательных степеней окисления водорода является важной основой для понимания его роли и значения в химии.