Неметаллы - это группа элементов периодической системы, которые обладают рядом уникальных свойств и отличаются от металлов. Свойства неметаллов объясняются их атомной структурой и способностью группироваться в молекулы. В отличие от металлов, неметаллы часто не проводят электрический ток и не обладают блеском.
Одним из ключевых свойств неметаллов является их способность атомов образовывать ковалентные связи. Ковалентная связь возникает при обмене электронами между атомами, что приводит к образованию молекул. Благодаря этому свойству неметаллы образуют различные соединения с другими элементами, включая металлы и другие неметаллы.
Кроме того, неметаллы обладают высокой электроотрицательностью, что означает их способность притягивать электроны в химических связях. Это свойство объясняет их неспособность проводить электрический ток, так как электроны плохо передаются между атомами неметаллов.
Каждый неметалл обладает своими уникальными свойствами. Например, кислород является газом, который играет важную роль в дыхании и горении. Азот образует 78% атмосферы Земли и является основным компонентом многих органических соединений. Водород - самый легкий элемент и составляет часть молекулы воды.
Таким образом, свойства неметаллов - это сочетание их атомной структуры, способности образовывать ковалентные связи и высокой электроотрицательности. Познание этих свойств позволяет лучше понять их роль в природе и применение в различных областях, от химической промышленности до медицины.
Что такое неметаллы: общая информация и классификация
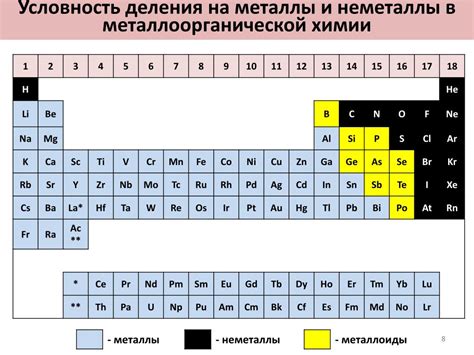
Существует несколько способов классификации неметаллов. По химическим свойствам они делятся на активные и инертные. Активные неметаллы обладают высокой активностью и способностью образовывать соединения с другими элементами. Инертные неметаллы, наоборот, практически не вступают в химические реакции и обычно встречаются в природе в свободном состоянии.
Еще одним способом классификации неметаллов является разделение их на группы в зависимости от состояния при обычных условиях (температуре и давлении): газообразные неметаллы, жидкие неметаллы и твердые неметаллы. К газообразным неметаллам относятся, например, кислород, водород и азот. Жидкими неметаллами являются бром и ртуть. В свою очередь, к твердым неметаллам относятся углерод, сера и фосфор.
Неметаллы играют важную роль в различных отраслях, включая химическую промышленность, электронику, материаловедение и экологию. Они могут быть использованы как исходные вещества для производства различных соединений и материалов, а также как катализаторы в химических реакциях. Некоторые неметаллы имеют также биологическое значение и являются необходимыми элементами для живых организмов.
В целом, понимание свойств неметаллов и их классификация позволяют разрабатывать новые материалы и технологии, а также глубже понять мир химии и природы.
Неметаллы: определение и примеры

Примеры неметаллов включают кислород, водород, азот, фтор, хлор и многие другие. Кислород, например, является жизненно важным элементом для существования на Земле и встречается в большом количестве в атмосфере и в водах.
Водород, самый легкий элемент, также является неметаллом. Он используется в производстве аммиака и других химических соединений, а также в качестве источника энергии в водородных топливных элементах.
Неметаллы играют важную роль в нашей повседневной жизни и находят широкое применение в различных отраслях, включая химическую промышленность, электронику, медицину и многое другое.
Свойства неметаллов в химии: основные характеристики

- Необразование ионов: неметаллы обычно не образуют положительно заряженных ионов, в отличие от металлов. Неметаллические элементы предпочитают получать отрицательные заряженные ионы, вступая в химические реакции.
- Силы, действующие между атомами: в основном, неметаллы образуют ковалентные связи, где электроны общие для нескольких атомов. Это приводит к образованию молекул, состоящих из атомов одного или разных элементов.
- Нет металлического блеска: в отличие от металлов, неметаллы обычно не имеют блеска на поверхности.
- Низкая электропроводность: из-за того, что неметаллы образуют ковалентные связи, электроны плохо проводятся, и поэтому большинство неметаллов являются плохими проводниками электричества.
- Высокая электроотрицательность: неметаллы, как правило, обладают большой способностью притягивать электроны к себе. Это связано с их стремлением получить отрицательный заряд.
- Пониженная плотность: в отличие от металлов, неметаллы обычно имеют низкую плотность, что объясняется их атомной структурой.
- Вещества с различными физическими состояниями: неметаллы могут находиться в различных физических состояниях при разных температурах и давлениях. Некоторые неметаллы находятся в газообразном состоянии (например, кислород), жидком состоянии (например, бром) или твердом состоянии (например, сера).
Все эти свойства придают неметаллам их характерные особенности и позволяют им образовывать различные соединения, включая простые и сложные вещества.
Химические свойства неметаллов: реакционная способность

Окислительные свойства неметаллов позволяют им образовывать соединения с металлами, вытесняя их из их солей. Например, хлор (Cl) может вытеснить медь из раствора ее соли, образуя хлорид меди (CuCl2).
Некоторые неметаллы образуют кислоты при взаимодействии с водой. Например, оксид серы (SO3) реагирует с водой, образуя серную кислоту (H2SO4). Кислоты проявляют кислотные свойства, такие как способность реагировать с металлами и нейтрализировать основания.
Неметаллы также обладают способностью образовывать ковалентные связи, в результате которых образуются сложные молекулы. Например, молекула воды (H2O) состоит из атомов кислорода и водорода, которые связаны ковалентной связью.
Реакционная способность неметаллов зависит от их электроотрицательности. Относительное расположение неметаллов в периодической системе Менделеева также может указывать на их реакционную способность. Например, хлор (Cl) в периоде расположен ближе к галогенам, и поэтому обладает большей реакционной способностью по сравнению с газообразным кислородом (O).
Химические свойства неметаллов определяют их функциональное использование в различных областях, таких как производство кислот, полупроводников, пластмасс и других веществ.
Физические свойства неметаллов: плотность, теплопроводность и т.д.
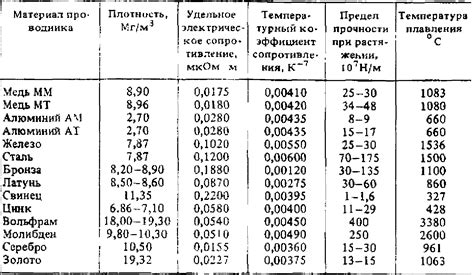
Неметаллы, в отличие от металлов, обладают рядом особых физических свойств.
Плотность: Неметаллы обычно имеют низкую плотность. Это означает, что они обладают небольшой массой в отношении к своему объему. Например, газообразные неметаллы, такие как водород и кислород, имеют очень низкую плотность.
Теплопроводность: Неметаллы обычно являются плохими проводниками тепла. Это связано с их структурой, которая не позволяет свободно перемещаться энергии тепла. Например, дерево и пластик имеют низкую теплопроводность.
Электропроводность: Большинство неметаллов являются плохими проводниками электричества. Они не обладают свободно движущимися электронами, которые могут переносить электрический ток. Однако некоторые неметаллы, такие как графит, обладают специальной структурой, что позволяет им проводить электричество в определенных условиях.
Точка плавления: Неметаллы обычно имеют низкие точки плавления. Это означает, что они могут переходить из твердого состояния в жидкое или газообразное при относительно низких температурах. Например, уголь имеет очень низкую точку плавления, поэтому может гореть при комнатной температуре.
Теплоемкость: Неметаллы как правило имеют низкую теплоемкость. Это означает, что они требуют относительно малого количества тепла для повышения их температуры. Это связано с их низкой плотностью и слабыми межатомными связями.
В целом, физические свойства неметаллов определяют их уникальные характеристики и различия от металлов. Эти свойства играют важную роль в применении неметаллов в различных областях науки и технологии.
Неметаллы в природе: естественное распространение
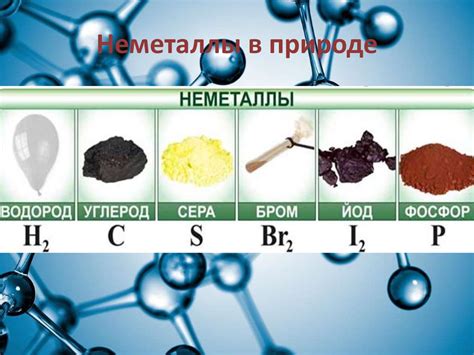
Одним из самых известных неметаллов является кислород. Он является основным компонентом воздуха и составляет около 21% его общего состава. Кислород также образует соединения с другими элементами, такими как вода и оксиды различных металлов.
Еще одним распространенным неметаллом является углерод. Он находится в различных формах, включая графит, алмазы и уголь. Углерод играет важную роль в органической химии и является основным компонентом жизненных форм на Земле.
Азот является еще одним неметаллом, который широко распространен в природе. Он составляет большую часть атмосферного воздуха и играет важную роль в многих биологических процессах. Азот также образует соединения с другими элементами и встречается в виде аммиака или нитратов в почве и воде.
Фосфор также является распространенным неметаллом в природе. Он соединяется с кислородом и образует фосфаты, которые являются важными компонентами горных пород и почвы. Фосфор также играет роль в жизненных процессах растений и животных.
Сера является еще одним распространенным неметаллом, которое встречается в природе. Она может быть найдена в виде серного меркурия, серных комплексных соединений или в неорганических соединениях, таких как серные кислоты.
Все эти неметаллы имеют различные свойства и особенности, но их естественное распространение является значимым для многих процессов, происходящих в нашей природе.
Использование неметаллов в промышленности: применение и значение

Неметаллы играют важную роль в различных отраслях промышленности благодаря своим свойствам и особенностям. Они широко используются как сырье для производства различных материалов и химических соединений.
Одно из основных применений неметаллов – производство пластиков. Пластмассы на основе нефти имеют высокую прочность, легкость и химическую стойкость, что делает их незаменимыми для различных изделий, от упаковочных материалов до автомобильных деталей.
Силикатные материалы, такие как стекло и керамика, также широко используются в промышленности. Стекло используется в производстве окон, бутылок, зеркал и многих других предметов. Керамика применяется в производстве посуды, плиток, санитарно-технической продукции и других товаров.
Одним из наиболее важных неметаллов считается кремний. Он используется в электронике для производства полупроводниковых чипов и солнечных батарей. Кремний также широко применяется в строительстве и авиационной промышленности.
Другим примером применения неметаллов является производство удобрений. Азот, фосфор и калий, являющиеся основными компонентами минеральных удобрений, представлены неметаллами. Удобрения на основе этих элементов играют важную роль в сельском хозяйстве, повышая урожайность и качество сельскохозяйственных культур.
Также неметаллы используются в качестве катализаторов в химической промышленности. Например, платина широко применяется в процессе каталитического крекинга нефти, что позволяет получить больше бензина и дизельного топлива из сырой нефти.
Использование неметаллов в промышленности имеет огромное значение для развития экономики и современного производства. Благодаря своим свойствам и разнообразным применениям, неметаллы играют важную роль в создании различных товаров и технологий.
Биологическое значение неметаллов для живых организмов

Неметаллы играют важную роль в жизнедеятельности живых организмов. Они участвуют в различных биохимических процессах, выполняют функции катализаторов и структурных элементов органических соединений. Рассмотрим основные неметаллы и их биологическое значение для живых организмов:
- Кислород (O) – один из самых важных неметаллов для живых организмов. Он необходим для дыхания и окисления органических веществ. Кислород также участвует в процессе окисления глюкозы в клетках, образуя энергию, необходимую для жизнедеятельности организма.
- Углерод (C) – основной строительный элемент органических молекул. Вместе с водородом и кислородом, углерод образует основу органических соединений, таких как углеводы, липиды, белки и нуклеиновые кислоты. Углерод также является основным компонентом ДНК и РНК, носителями генетической информации.
- Азот (N) – необходим для синтеза белков и нуклеиновых кислот. Аминокислоты, основные строительные блоки белков, содержат атомы азота. Азот также является частью нуклеотидов, составляющих нуклеиновые кислоты ДНК и РНК.
- Фосфор (P) – входит в состав нуклеотидов и фосфолипидов, которые являются структурными компонентами нуклеиновых кислот и клеточных мембран. Фосфор также необходим для энергетических процессов, таких как синтез АТФ, основного источника энергии в клетках.
- Сера (S) – является частью аминокислоты цистеина, которая играет важную роль в структуре белков и ферментов. Сера также участвует в процессах детоксикации и образования дисульфидных связей, обеспечивающих стабильность пространственной структуры белков.
Важно отметить, что неметаллы для живых организмов должны быть в определенных концентрациях. Иногда их недостаток или избыток может приводить к нарушениям в функционировании организма и развитию заболеваний.



