Таблица Менделеева, или периодическая система химических элементов, является основой для организации и классификации всех химических элементов. В ней каждый элемент представлен своим символом, а также указано его атомное число, массовое число и электронная конфигурация. Атомное число определяет число протонов в ядре атома, а массовое число - суммарное число протонов и нейтронов. А электронная конфигурация показывает, как электроны распределены по энергетическим уровням.
Нейтроны - одна из трех элементарных частиц, составляющих атомные ядра. Они не несут электрический заряд и участвуют в формировании стабильности ядра. Протоны - еще одна элементарная частица, имеющая положительный электрический заряд и также составляющая ядро атома. Электроны, с другой стороны, обращаются вокруг ядра по определенным орбитам и имеют отрицательный электрический заряд.
Число нейтронов, протонов и электронов в атоме может варьироваться в зависимости от конкретного элемента. Например, у водорода, самого простого элемента, в ядре находится всего один протон и вместе с этим один электрон обращается вокруг. У более сложных элементов, таких как углерод, количество нейтронов и протонов значительно выше, а количество электронов может быть больше нескольких десятков.
Таблица Менделеева: основная информация

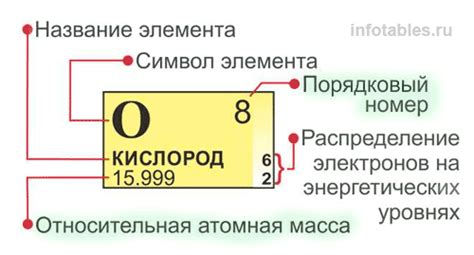
В таблице Менделеева каждый элемент представлен своим символом и атомным номером. Атомный номер указывает на количество протонов в ядре атома, а также определяет порядковый номер элемента в таблице. Символ элемента состоит из одной или двух букв, которые обычно соответствуют его латинскому или греческому названию.
Каждый элемент также характеризуется своей атомной массой, которая представляет собой среднюю массу атомов элемента, учитывая протоны и нейтроны в ядре. Атомная масса указывается под символом элемента.
Таблица Менделеева разделена на периоды (горизонтальные строки) и группы (вертикальные столбцы). Периоды соответствуют количеству энергетических оболочек у атомов элементов, а группы отражают количество электронов на внешней энергетической оболочке.
Каждой группе также соответствует своеобразное название, например, щелочные металлы, инертные газы и т.д. Некоторые группы имеют общие химические свойства, что облегчает изучение и понимание химических реакций и связей между элементами.
Таблица Менделеева является неотъемлемой частью химических исследований и применяется в научных и практических целях. Она помогает определить свойства элементов, предугадать тип химической реакции и способствует развитию химии и промышленных технологий.
Число нейтронов, протонов и электронов: как определяется
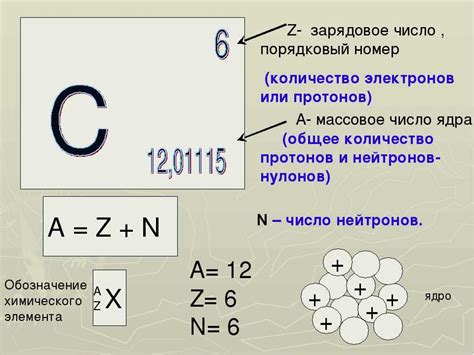
Протоны и нейтроны находятся в ядре атома, в то время как электроны располагаются вокруг ядра. Число протонов определяет атомный номер элемента и указано в верхней части ячейки в таблице Менделеева. Например, у водорода атомный номер равен 1, что означает, что у него есть только 1 протон.
Число нейтронов определяется путем вычитания числа протонов из атомной массы элемента, указанной в нижней части ячейки. Например, у водорода атомная масса равна примерно 1,01, и поскольку у него только 1 протон, количество нейтронов равно примерно 0 (1,01 - 1 = 0,01).
Электроны располагаются в оболочках вокруг ядра и имеют отрицательный заряд. Число электронов для каждого элемента равно числу протонов, что обусловлено тем, что атомы обычно являются электрически нейтральными. Например, у водорода 1 протон и, соответственно, 1 электрон.
Таблица Менделеева предоставляет удобный способ определить число нейтронов, протонов и электронов для каждого элемента в периодической системе. Эта информация является основой для понимания структуры и свойств химических элементов.
| Элемент | Протоны | Нейтроны | Электроны |
|---|---|---|---|
| Водород | 1 | 0 | 1 |
| Углерод | 6 | 6 | 6 |
| Золото | 79 | 118 | 79 |
Распределение нейтронов, протонов и электронов в элементах

Нейтроны, протоны и электроны в атоме осуществляют основные функции и обладают определенными свойствами. Нейтроны не имеют заряда и находятся в ядре атома вместе с протонами, которые имеют положительный заряд. Электроны, имеющие отрицательный заряд, обращаются вокруг ядра по различным энергетическим орбитам.
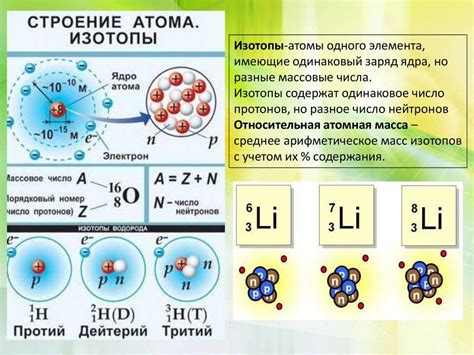
Число нейтронов в атоме элемента может варьироваться и определяется его изотопами. Изотопы – это атомы одного и того же элемента, отличающиеся только числом нейтронов в ядре. Количество протонов в атоме определяет его атомный номер, а количество электронов, как правило, равно количеству протонов и определяет заряд атома.
Таблица Менделеева позволяет легко определить количество нейтронов, протонов и электронов в атоме каждого элемента. Изучение этих характеристик элементов позволяет углубить понимание и изучение химических свойств и реакций. Распределение нейтронов, протонов и электронов в атомах элементов – это важная информация для химиков и научных исследователей, которые изучают химические процессы и определяют взаимодействия между элементами в различных системах.
Таблица Менделеева и химические свойства элементов
Химические свойства элементов включают физические и химические характеристики, такие как плотность, температура плавления и кипения, электроотрицательность, способность проявлять химическую активность и образовывать соединения.
Расположение элементов в таблице Менделеева отражает их взаимосвязь и сходство химических свойств. Элементы, расположенные в одном вертикальном столбце, называются группами, и они имеют похожие свойства. Элементы, находящиеся в одной горизонтальной строке, называются периодами, и они имеют постепенно изменяющиеся характеристики.
Таблица Менделеева удобна для изучения и анализа химических свойств элементов, а также для прогнозирования поведения элементов и создания новых соединений. Она является основой современной химии и регулярно обновляется с появлением новых элементов и результатах последних исследований.
| Символ элемента | Атомный номер | Химические свойства |
|---|---|---|
| H | 1 | Газ, без цвета и запаха, самый легкий элемент, взрывоопасен в сочетании с кислородом, образует воду при соединении с кислородом. |
| He | 2 | Безцветный газ, самый легкий инертный газ, используется в заполнении воздушных шаров и в качестве среды для гелиевых лазеров. |
| Li | 3 | Мягкий металл, реагирует с водой с выделением водорода, используется в литий-ионных аккумуляторах и лекарствах. |
| Be | 4 | Тугоплавкий металл, довольно реактивен, используется для улучшения свойств сплавов и в ядерной энергетике. |
Зависимость числа нейтронов, протонов и электронов от атомной массы
Атомная масса элемента определяет его положение в Таблице Менделеева и имеет прямую связь с числом нейтронов, протонов и электронов в атоме.
Протоны и нейтроны находятся в атомном ядре, а электроны обращаются по определенным энергетическим уровням вокруг ядра. Число протонов определяет атомный номер элемента и совпадает с числом электронов в нейтральном атоме. Таким образом, атомный номер можно использовать для определения числа протонов и электронов в атоме.
Изменение числа нейтронов в атоме приводит к образованию изотопов элемента. Изотопы имеют различное число нейтронов, но сохраняют одинаковое число протонов и электронов. Значит, в атоме может быть разное число нейтронов, но оно не влияет на химические свойства элемента, так как они зависят только от числа протонов и электронов.
Таблица Менделеева представляет собой удобное средство для изучения зависимости между атомной массой, числом нейтронов, протонов и электронов элементов. Путем анализа данных в таблице можно установить закономерности и тенденции, связанные с изменением этих параметров в периодической системе.
Изотопы элементов: как они влияют на количество нейтронов
Нейтроны являются нейтральными частицами и не влияют на химические свойства элемента. Однако количество нейтронов в атоме может изменяться и влиять на его физические свойства, такие как масса и стабильность.
Например, углерод – элемент с атомным номером 6. В стандартном состоянии углерода число нейтронов равно 6, что делает его самым распространенным изотопом. Однако существуют и другие изотопы углерода, например, углерод-14, у которого число нейтронов равно 8. Этот изотоп используется в радиоуглеродном анализе и в археологии для определения возраста органических останков.
Изотопы не только влияют на количество нейтронов, но и могут различаться по своей стабильности. Некоторые изотопы являются радиоактивными и подвергаются распаду со временем, выпуская радиацию. Другие изотопы являются стабильными и не подвергаются распаду.
Изучение изотопов элементов позволяет углубить наше понимание о строении атома, его свойствах и процессах, происходящих в нем. Также это находит практическое применение в различных областях науки, технологии и медицине.
Электрический заряд элементов и количество электронов
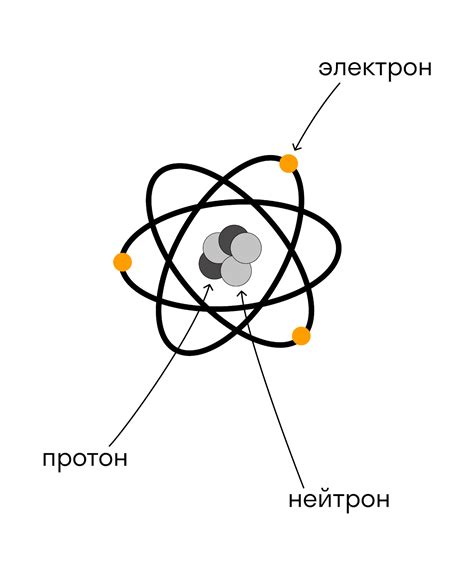
Электрический заряд элементов связан с их атомной структурой и количеством электронов в атоме. В атоме находится ядро, состоящее из протонов с положительным зарядом и нейтронов без заряда. Вокруг ядра располагаются электроны с отрицательным зарядом.
Количество электронов в атоме характеризует распределение электронов по энергетическим уровням. Первый энергетический уровень может содержать до 2 электронов, второй - до 8 электронов, третий - до 18 электронов, четвертый - до 32 электронов и т.д. Суммарное количество электронов в атоме равно атомному номеру элемента в таблице Менделеева.
Изменение количества электронов в атоме приводит к образованию ионов - атомов с положительным или отрицательным зарядом. Когда атом теряет электрон или электроны, он становится положительно заряженным ионом. Например, натрий (Na) имеет атомный номер 11 и 11 электронов. При потере одного электрона он превращается в положительно заряженный ион Na+.
Если атом получает дополнительные электроны, он становится отрицательно заряженным ионом. Например, кислород (O) имеет атомный номер 8 и 8 электронов. При получении двух электронов он превращается в отрицательно заряженный ион O2-.
Таким образом, электрический заряд элементов определен их атомными номерами и распределением электронов в атоме.
Применение таблицы Менделеева и числа нейтронов, протонов и электронов в науке и технологиях

Одним из ключевых параметров элемента является его атомное число, которое определяет количество протонов в ядре атома и равно количеству электронов в нейтральном атоме. Вторым важным параметром является число нейтронов, которые находятся в ядре вместе с протонами и обусловливают массу атома.
Знание числа нейтронов, протонов и электронов в атоме позволяет ученым понять и предсказать свойства различных веществ и элементов. Это является ключевым в понимании химических реакций, образования соединений и разработке новых материалов.
В науке и технологиях применение таблицы Менделеева и знание числа нейтронов, протонов и электронов обеспечивает основу для создания новых материалов с определенными свойствами. Например, в области материаловедения, если известно число нейтронов и протонов в атоме, можно предсказать его радиус, электронную структуру и электронную конфигурацию. Это помогает в разработке новых материалов с определенными свойствами, таких как прочность, проводимость тока или магнитные свойства.
Кроме того, знание числа нейтронов, протонов и электронов позволяет ученым предсказывать и изучать радиоактивные свойства элементов, проводить эксперименты с элементами и разрабатывать новые технологии в области промышленного производства, энергетики и медицины.
Таким образом, применение таблицы Менделеева и знание числа нейтронов, протонов и электронов в науке и технологиях является фундаментальным и необходимым для достижения прогресса во многих областях, от разработки новых материалов до создания новых технологий и улучшения нашей жизни.