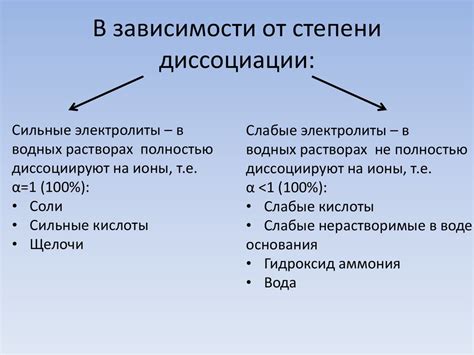
Степень диссоциации – это величина, которая описывает, насколько полностью реакция диссоциации вещества протекает в заданных условиях. Она измеряется в процентах или долях единицы и позволяет оценить эффективность диссоциации сильной или слабой кислоты, основания или соли.
Степень диссоциации зависит от различных факторов, одним из которых является температура. Обычно с повышением температуры степень диссоциации возрастает, поскольку теплота, поступающая в систему, обеспечивает избыток энергии, необходимой для разрыва связей в молекуле вещества.
Однако сталкиваются ситуации, когда повышение температуры может привести к обратному эффекту. В некоторых случаях степень диссоциации может уменьшаться, а даже прекращаться полностью при достижении определенной температуры, называемой точкой конденсации или точкой кипения. Это объясняется изменением равновесия реакции под влиянием изменения температуры и становится основой для понимания зависимости степени диссоциации от температуры.
Степень диссоциации и зависимость от температуры

При повышении температуры обычно наблюдается увеличение степени диссоциации. Это связано с тем, что при более высоких температурах молекулы вещества обладают большей кинетической энергией и могут преодолевать энергетический барьер, необходимый для распада на ионы.
Однако существуют исключения, когда повышение температуры может уменьшить степень диссоциации. Это может быть связано с тем, что при высоких температурах реакция обратного образования может стать более быстрой, что приводит к уменьшению количества ионов в растворе.
Зависимость степени диссоциации от температуры может быть описана с помощью различных математических моделей и уравнений. Одной из наиболее распространенных моделей является уравнение Вант-Гоффа, которое связывает степень диссоциации с константой равновесия и температурой.
Понимание зависимости степени диссоциации от температуры является важным для различных областей науки и технологии, включая химическую кинетику, физическую химию и процессы синтеза и разложения соединений. Изучение этой зависимости позволяет более точно прогнозировать и контролировать химические реакции и процессы.
Определение и понятие степени диссоциации

Степень диссоциации обозначается символом α и измеряется в процентах или в виде десятичной дроби от 0 до 1. При α = 0 соединение не диссоциировано (не распадается на ионы), а при α = 1 оно полностью диссоциировано.
Степень диссоциации зависит от различных факторов, включая тип соединения, концентрацию растворителя, температуру и давление. Вещества, которые легко распадаются на ионы в растворе, имеют высокую степень диссоциации, а те, которые плохо диссоциированы, имеют низкую степень диссоциации.
Степень диссоциации играет важную роль в применении химических реакций и уравнений, а также в расчетах свойств растворов. Она позволяет определить количество ионов, образующихся в растворе, и рассчитать концентрацию раствора на основе этих данных.
Причины зависимости степени диссоциации от температуры

1. Изменение энергии активации: При повышении температуры энергия активации реакции уменьшается. Это приводит к большей вероятности перехода молекул из исходного состояния в активное состояние. Таким образом, более высокая температура способствует большей доле молекул, претерпевающих диссоциацию.
2. Изменение константы равновесия: Зависимость константы равновесия от температуры может привести к изменению степени диссоциации. В некоторых реакциях диссоциация сопровождается выделением тепла или его поглощением. В таких случаях изменение температуры оказывает прямое влияние на значение константы равновесия.
3. Изменение концентрации реакционных частиц: Повышение температуры может приводить к физическому расширению системы и увеличению концентрации реагентов. При этом, степень диссоциации может изменяться, поскольку больше молекул реагентов становится доступно для реакции.
4. Изменение энергии связи: Повышение температуры может приводить к увеличению энергии связи между атомами или молекулами. Это может снизить скорость обратной диссоциации, что приведет к увеличению степени диссоциации.
5. Изменение кинетических параметров: Температура оказывает влияние на скорость реакции. При повышении температуры, реакция может протекать быстрее, что приводит к более полной диссоциации в определенных химических системах.
Итак, зависимость степени диссоциации от температуры обусловлена несколькими факторами, включая энергию активации, константу равновесия, концентрацию реакционных частиц, энергию связи и кинетические параметры. Понимание этих причин позволяет лучше понять, как температура влияет на процессы диссоциации в химических реакциях.
Теплота диссоциации и ее влияние на степень диссоциации

Теплотой диссоциации называется количество энергии, которое необходимо для разделения одного моля вещества на его составляющие части. Это величина, которая определяет степень диссоциации вещества.
Степень диссоциации, обозначаемая символом α, является отношением числа молекул, которые диссоциировали, к исходному числу молекул вещества. Влияние теплоты диссоциации на степень диссоциации обусловлено термодинамическими законами и следующими факторами:
1. Температура: При повышении температуры теплота диссоциации реакции увеличивается, что приводит к увеличению степени диссоциации. Это объясняется тем, что при повышении температуры частицы вещества обладают большей энергией, что способствует их разделению.
2. Концентрация вещества: При увеличении концентрации вещества теплота диссоциации уменьшается, что приводит к уменьшению степени диссоциации. Это связано с тем, что при увеличении концентрации реакция протекает в обратном направлении, что уменьшает количество диссоциировавших молекул.
3. Давление: Давление оказывает незначительное влияние на теплоту диссоциации и степень диссоциации. Однако, при высоком давлении, степень диссоциации может быть незначительно выше из-за более плотного упаковывания молекул.
Таким образом, теплота диссоциации является важным показателем, описывающим степень диссоциации вещества и зависит от температуры, концентрации и давления. Понимание этих факторов позволяет лучше понять химические реакции и их термодинамические свойства.
Зависимость степени диссоциации от концентрации реагентов

Зависимость α от концентрации (С) может быть описана уравнением диссоциации. Чаще всего используется уравнение первого порядка:
α = k * С
Здесь α – степень диссоциации, С – концентрация реагента, k – постоянная диссоциации, характеризующая скорость распада реагента на молекулы раствора.
С точки зрения термодинамики, зависимость степени диссоциации от концентрации реагентов может быть представлена как:
α = Kp * Pр
Здесь α – степень диссоциации, Kp - постоянная равновесия, Pр – парциальное давление реагента.
Интересно отметить, что зависимость степени диссоциации от концентрации реагентов может быть различной для разных реакций. Например, ионообменные реакции обычно сопровождаются постепенным возрастанием степени диссоциации с увеличением концентрации реагентов.
Таким образом, понимание зависимости степени диссоциации от концентрации реагентов позволяет более точно предсказывать поведение химических систем и контролировать процессы диссоциации.
Практическое применение степени диссоциации

| Область применения | Примеры |
|---|---|
| Аналитическая химия | Степень диссоциации позволяет определить концентрацию и состав растворов, что особенно полезно при исследовании медицинских проб или контроле качества продукции. |
| Физическая химия | Знание степени диссоциации позволяет рассчитывать термодинамические величины, такие как энтальпия и энтропия. Это важно для изучения процессов, происходящих в различных химических системах. |
| Фармацевтическая химия | Степень диссоциации может быть использована для определения биодоступности лекарственных препаратов, и исследования их эффективности и безопасности. |
| Электрохимия | Степень диссоциации важна для рассчета электродной энергии и предсказания электрохимической активности вещества в различных реакциях, что полезно при разработке эффективных батарей и электролитов. |
В целом, знание степени диссоциации позволяет более точно понимать и предсказывать химические процессы, что делает это понятие незаменимым инструментом для химиков во многих областях науки и промышленности.
Заключительные мысли: понимание и изучение степени диссоциации
Степень диссоциации определяет, насколько эффективно молекулы вещества разделяются на ионы или радикалы при взаимодействии с растворителем или при повышении температуры. Знание этого позволяет уточнить состав реакционной смеси и предсказать продукты реакции.
Изучение степени диссоциации также позволяет анализировать химические реакции и применять их в промышленных процессах. Например, знание степени диссоциации может помочь определить оптимальные условия для производства определенного продукта или улучшить эффективность химического процесса.
Понимание и изучение степени диссоциации требует использования различных методов и техник, таких как экспериментальные измерения, математическое моделирование, термодинамические расчеты и т.д. Комбинирование этих методов позволяет получить точные и надежные данные о степени диссоциации вещества.
В целом, изучение степени диссоциации и зависимости от температуры имеет широкое практическое применение и является важным аспектом в области химической науки. Приобретение знаний об этом явлении позволяет лучше понять и контролировать множество химических процессов и, таким образом, способствует развитию науки и промышленности.



