Нуклеиновые кислоты являются основой для хранения, передачи и экспрессии наследственной информации у всех живых организмов. Установление точного состава нуклеиновых кислот – важнейший этап их исследования, позволяющий определить последовательность нуклеотидов и проанализировать различные изменения, связанные с заболеваниями и эволюцией.
Существует несколько методов для установления состава нуклеиновых кислот. Один из таких методов – это электрофорез, который основан на разделении молекул нуклеиновых кислот по их размерам и заряду. С помощью электрофореза можно определить количество и размеры фрагментов нуклеиновых кислот, а также проанализировать их структуру и последовательность.
Другим распространенным методом является секвенирование, которое позволяет установить точную последовательность нуклеотидов в молекуле нуклеиновой кислоты. Стандартным методом секвенирования является метод Сэнгера, основанный на использовании дидезоксинуклеотидов, которые прерывают синтез ДНК в определенных местах и позволяют определить последовательность нуклеотидов.
В последние годы также развиваются новые методы установления состава нуклеиновых кислот, такие как методы масс-спектрометрии и секвенирование следующего поколения. Они позволяют проводить анализ больших объемов данных, получать информацию о полной последовательности генома и производить множественное секвенирование с высокой точностью и скоростью.
Новые методы анализа нуклеиновых кислот
Одним из самых популярных методов является метод ДНК-секвенирования, который позволяет определить последовательность нуклеотидов в ДНК-молекуле. С развитием технологий, появились новые методы секвенирования, такие как методы массового параллельного секвенирования (NGS), которые позволяют значительно увеличить скорость и точность анализа.
Помимо методов секвенирования, есть и другие инновационные методы. Например, метод CRISPR/Cas9, который позволяет редактировать геном на уровне нуклеиновых кислот. С помощью этого метода ученые могут вносить изменения в геномные последовательности и изучать их влияние на функции организма.
Еще одним интересным методом является метод одноцепочечного полиморфизма (SSCP), который используется для анализа генетических вариаций. Этот метод основан на обнаружении различий в электрофоретической подвижности одноцепочечных фрагментов нуклеиновых кислот. SSCP позволяет идентифицировать нуклеотидные замены, инсерции и делеции.
Кроме того, исследователи также разрабатывают новые методы анализа рНК – второй важной нуклеиновой кислоты. Например, методы RNA-seq позволяют изучать выражение генов на уровне рНК-молекулы и идентифицировать новые рНК-молекулы.
Новые методы анализа нуклеиновых кислот позволяют углубить наше понимание генетической информации и открыть новые пути для исследований в области генетики и молекулярной биологии.
Методы изоляции ДНК и РНК
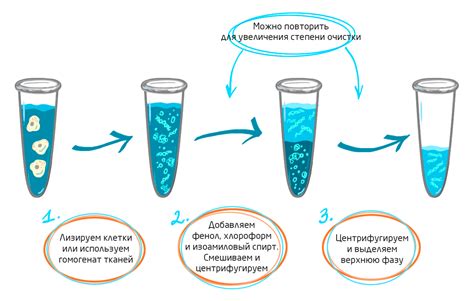
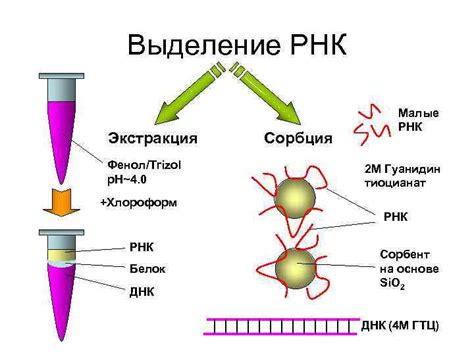
Существуют различные методы изоляции ДНК и РНК, которые позволяют успешно выделить эти молекулы из клеточных материалов. Ключевыми шагами во всех методах изоляции являются разрушение клеточных мембран и ядер, разделение нуклеиновых кислот от остальных компонентов клеток и удаление примесей. В зависимости от цели исследования, используются различные принципы и технологии для обеспечения успешной изоляции ДНК и РНК.
Вот несколько основных методов изоляции ДНК:
- Феноль-хлороформная экстракция. Этот метод основан на разделении фаз, где ДНК из кислых растворителей переходит в органическую фазу.
- Использование магнитных шариков. ДНК может быть изолирована с помощью специальных наночастиц, таких как магнитные шарики, к которым ДНК будет привязываться.
- Индуцированная высолина. Специфическая соль используется для осаждения ДНК из раствора.
А вот несколько основных методов изоляции РНК:
- Феноль-хлороформная экстракция в сочетании с использованием трешола. Этот метод позволяет успешно изолировать РНК из клеток или тканей.
- Использование кислоты гуанидина. В связи с особенностями химической структуры РНК, гуанидиновая соль позволяет выделить РНК из пробирки.
- Использование колонок с сепаратом. Специальные колонки с гелеобразующим материалом позволяют фильтровать ДНК из раствора и получить высокоочищенную РНК.
Методы изоляции ДНК и РНК развиваются и усовершенствуются с течением времени, чтобы обеспечить более эффективное и точное выделение нуклеиновых кислот. Точный выбор метода изоляции зависит от множества факторов, включая тип и количество исходного материала, конечная цель исследования и доступные ресурсы.
Электрофорез как метод фракционирования нуклеиновых кислот
Принцип работы электрофореза заключается во взаимодействии нуклеиновых кислот с электрическим полем. Под воздействием электрического поля, нуклеиновые кислоты мигрируют в геле или другой матрице на основе их электрического заряда и размера. Нуклеиновые кислоты с положительным зарядом мигрируют к отрицательному электроду, а с отрицательным зарядом - к положительному электроду.
Для проведения электрофореза необходимо подготовить гель, который будет использоваться в качестве матрицы. В качестве матрицы может использоваться агарозный или полиакриламидный гель. Нуклеиновые кислоты помещаются в гель и подвергаются действию электрического поля.
Во время электрофореза нуклеиновые кислоты разделяются на основе их размера и заряда. Крупные кислоты имеют меньшую скорость миграции и останавливаются ближе к начальному положению, а маленькие кислоты перемещаются дальше.
После завершения электрофореза, гель можно визуализировать с помощью различных методов окрашивания или использования радиоактивных мечителей, что позволяет определить положение и количество различных фракций нуклеиновых кислот.
Хроматографические методы анализа ДНК и РНК
Одним из наиболее распространенных хроматографических методов анализа ДНК и РНК является жидкостная хроматография. В процессе этого метода образец нуклеиновых кислот разделяется на компоненты на основе их аффинности к стационарной фазе и подвижности в подвижной фазе. Жидкостная хроматография позволяет достигнуть высокой разделительной способности и хорошей репродуцируемости результатов.
Газовая хроматография также широко используется для анализа нуклеиновых кислот. В этом методе образец паровой фазы проходит через колонку с неподвижной фазой и разделяется на компоненты на основе их различий в аффинности к неподвижной фазе. Газовая хроматография обладает высокой разделительной способностью, но требует специального оборудования и опыта для проведения анализа.
Другим хроматографическим методом анализа нуклеиновых кислот является тонкослойная хроматография. В этом методе образец нуклеиновых кислот наносится на тонкий слой сорбента и разделяется на компоненты на основе их взаимодействия с сорбентом и подвижной фазой. Тонкослойная хроматография обеспечивает быстрый и недорогой анализ, но имеет ограничения в разделительной способности.
Хроматографические методы анализа ДНК и РНК широко используются в различных областях биологических и медицинских исследований. Они позволяют определить состав и структуру нуклеиновых кислот, исследовать их взаимодействие с другими молекулами, установить изменения в последовательности нуклеотидов и проводить сравнительный анализ между различными образцами.
Амплификация исходной ДНК и РНК методами ПЦР
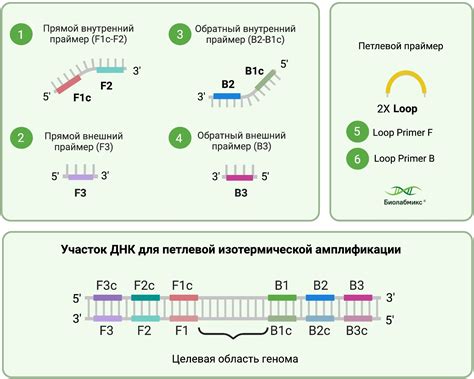
Принцип метода ПЦР основан на использовании специфических праймеров - коротких одноцепочечных фрагментов ДНК или РНК, которые гибридизируются с искомыми участками образца и служат стартовой платформой для синтеза новой ДНК цепи. ПЦР проводится в термостатированном аппарате, который позволяет циклически повторять серию реакций, включающих денатурацию, отжиг праймеров и синтез новых цепей с помощью термостабильной ДНК-полимеразы.
Амплификация ДНК методом ПЦР может быть использована во многих областях, включая медицинскую диагностику, генетические исследования, судебно-медицинскую экспертизу и многое другое. Так, например, метод ПЦР позволяет проводить детектирование генетических мутаций и вариаций, определение наличия инфекций, идентификацию лиц по ДНК и многое другое.
Амплификация РНК методом ПЦР, известная также как обратная транскрипционная ПЦР (RT-PCR), позволяет анализировать экспрессию генов, то есть изучать активность генов и уровень их экспрессии. Этот метод позволяет выявить наличие и количество мРНК конкретного гена в исследуемом образце. RT-PCR широко применяется в исследованиях генных и белковых выражений, онкологии и других областях биологии и медицины.
Амплификация исходной ДНК и РНК методами ПЦР является мощным инструментом для получения больших количеств целевых молекул с высокой специфичностью и чувствительностью. Этот метод обеспечивает быстрый и эффективный способ анализа исходного материала, что делает его неотъемлемым инструментом в современной молекулярной биологии и медицине.
Секвенирование нуклеотидов для определения последовательности
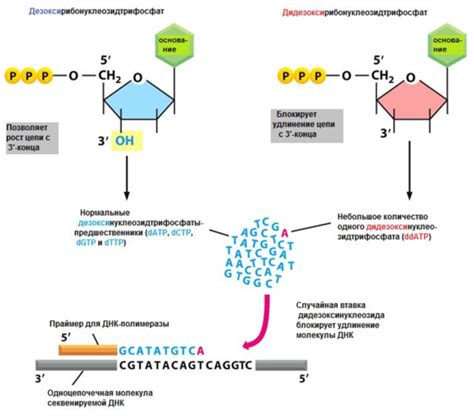
Существует несколько методов секвенирования нуклеотидов, которые различаются по принципу работы и точности результатов. Одним из самых распространенных методов является метод секвенирования по Сэнгеру.
Метод секвенирования по Сэнгеру основан на использовании дидезоксинуклеотидов (ddNTP), которые контролируют прекращение синтеза цепи ДНК на определенном нуклеотиде. В результате смешения реакционной смеси, содержащей матричный ДНК, фрагменты ДНК различной длины и зависимости от инкорпорированных ddNTP, получаем набор лигированных фрагментов, имеющих длину, равную прерыванию в каждом нуклеотиде цепи молекулы ДНК.
Полученные фрагменты подвергаются сортировке соответственно их длине на электрофоретическом геле. Затем гель анализируется с помощью флюоресцентного детектора, который считывает последовательность нуклеотидов. Компьютерный алгоритм затем преобразует данные детектора в последовательность нуклеотидов.
Метод секвенирования по Сэнгеру имеет высокую точность, но он довольно затратен и трудоемок. Поэтому сейчас активно исследуются новые технологии секвенирования, такие как методы "следующего поколения".
Методы "следующего поколения" предлагают более быстрый и более доступный подход к секвенированию нуклеотидов. Они позволяют параллельно секвенировать тысячи или даже миллионы фрагментов ДНК одновременно, снижая стоимость и увеличивая скорость исследования.
Секвенирование нуклеотидов является ключевым методом для определения последовательности ДНК и РНК. Он имеет широкий спектр применения в биологических и медицинских исследованиях, поскольку позволяет расшифровать генетическую информацию и изучать функцию генов и отдельных участков генома.
Методы генетического этикетирования и меченообразования
Эти методы являются основой для многих современных исследований в области генетики и молекулярной биологии. Они позволяют идентифицировать конкретные гены или участки ДНК и РНК, а также определить их функции и взаимодействия с другими молекулами.
Одним из основных методов генетического этикетирования является метод флуоресцентной метки. В этом методе используются специальные флуорофоры, которые мечат определенные участки нуклеиновых кислот и позволяют их визуализировать с помощью флуоресцентного микроскопа. Это позволяет исследователям определить местоположение и количество конкретных молекул в клетках или тканях.
Другим распространенным методом генетического этикетирования является метод радиомечения. В этом методе используются радиоактивные изотопы, которые мечают нуклеиновые кислоты. После мечения, образцы подвергаются радиоактивному анализу, который позволяет определить количество и состав конкретных молекул.
Методы генетического этикетирования и меченообразования являются мощным инструментом в исследовании генетической информации. Они позволяют исследователям получить не только количественные, но и качественные данные о составе нуклеиновых кислот, что позволяет лучше понять их функции и роль в клетке и организме в целом.
Важно отметить, что использование этих методов требует специальной подготовки и соблюдение правил безопасности, так как они связаны с использованием радиоактивных и меченых веществ.
Использование флуоресцентных зондов для идентификации нуклеиновых кислот
Флуоресцентные зонды - это молекулы, способные поглощать и переизлучать свет определенной длины волны. Они могут быть специфично направлены на определенную последовательность нуклеиновой кислоты и использоваться для идентификации этой последовательности.
Процесс идентификации нуклеиновых кислот с использованием флуоресцентных зондов обычно включает несколько шагов:
- Выбор подходящего флуоресцентного зонда с соответствующей длиной волны эмиссии и поглощения для конкретного вида нуклеиновой кислоты.
- Разработка специфического праймера, содержащего флуоресцентный зонд, который будет связываться с целевой последовательностью нуклеиновой кислоты.
- Применение полимеразной цепной реакции (ПЦР) для увеличения количества целевой последовательности.
- Измерение флуоресценции, которая возникает при связывании флуоресцентного зонда с целевой последовательностью нуклеиновой кислоты.
- Анализ и интерпретация результатов для определения состава нуклеиновой кислоты.
Использование флуоресцентных зондов позволяет улучшить точность и скорость идентификации нуклеиновых кислот. Этот метод обеспечивает возможность учета специфичности и чувствительности флуоресцентного зонда к определенной последовательности, что помогает обнаруживать наличие и отсутствие конкретного фрагмента нуклеиновой кислоты.
Использование флуоресцентных зондов для идентификации нуклеиновых кислот находит широкое применение в различных областях науки, таких как генетика, диагностика заболеваний, и идентификация генетических вариантов. Этот метод позволяет более точно и быстро определить состав нуклеиновой кислоты, что открывает новые возможности для исследований и применений в молекулярной биологии.
Масс-спектрометрия для анализа и определения массы нуклеиновых кислот

Масс-спектрометр состоит из трех основных компонентов: ионизатора, анализатора масс и детектора. В процессе анализа нуклеиновых кислот, ионизатор обрабатывает образец, создавая ионы, которые затем проходят через анализатор масс, где происходит их разделение в соответствии с их массой-зарядовым соотношением. Разделенные ионы затем попадают на детектор, который их регистрирует и преобразует в электрические сигналы.
Масс-спектрометрия позволяет точно определить массу нуклеиновых кислот и их фрагментов, а также установить их последовательность. Этот метод позволяет исследовать различные характеристики нуклеиновых кислот, включая массу, длину, структуру и модификации.
Преимущества масс-спектрометрии включают высокую чувствительность и точность анализа, возможность работать с небольшими образцами и специализированными типами нуклеиновых кислот, а также способность обнаруживать различные модификации и метаболические процессы.
Масс-спектрометрия находит широкое применение в исследованиях генетики, молекулярной биологии, фармакологии и медицине. Она помогает ученым понять структуру и функцию нуклеиновых кислот, их взаимодействие с другими молекулами, а также разработать новые методы диагностики и терапии различных заболеваний.
Использование биосенсоров для определения состава нуклеиновых кислот

Одним из эффективных методов определения состава нуклеиновых кислот является использование биосенсоров. Биосенсоры - это устройства, которые используются для обнаружения и измерения биохимических процессов в живых организмах.
Биосенсоры для определения состава нуклеиновых кислот основаны на принципе специфического связывания ДНК или РНК с последующим измерением сигнала, который генерируется при этой связи. Существует несколько типов биосенсоров, которые могут быть использованы для этой цели.
Один из таких типов биосенсоров - электрохимические биосенсоры. Они основаны на изменении электрических параметров, таких как ток, напряжение или сопротивление, при связывании нуклеиновых кислот с соответствующими пробами.
Другой тип биосенсоров - оптические биосенсоры. Они используют оптические свойства нуклеиновых кислот, такие как поглощение и рассеяние света, для обнаружения и анализа ДНК или РНК.
Использование биосенсоров для определения состава нуклеиновых кислот имеет ряд преимуществ. Они обладают высокой чувствительностью и специфичностью, а также могут быть автоматизированы, что сокращает время и усилия, затрачиваемые на анализ.
С развитием технологий биосенсоров появляются все более эффективные и усовершенствованные методы определения состава нуклеиновых кислот. Использование биосенсоров в этой области исследований обещает новые возможности для диагностики и терапии различных генетических заболеваний.
Сравнительные исследования свойств различных видов нуклеиновых кислот
ДНК хранит информацию, необходимую для развития и функционирования организмов. Сравнительные исследования доказали, что состав ДНК может различаться у разных видов. Например, ДНК человека и шимпанзе имеют около 98% сходства, в то время как у человека и мыши это значение составляет всего 85%. Такие различия в составе ДНК могут оказывать влияние на фенотип и характеристики организмов.
Также проводятся исследования свойств РНК. РНК выполняет различные функции в клетках, включая трансляцию генетической информации и участие в регуляции экспрессии генов. Исследования показали, что разные виды РНК могут отличаться по длине и структуре. Например, микроРНК (miRNA) состоит из коротких последовательностей нуклеотидов и участвует в регуляции экспрессии генов путем связывания и ингибирования мишенных молекул РНК.
Для проведения сравнительных исследований свойств нуклеиновых кислот используются различные методы, такие как гель-электрофорез, пЦР (полимеразная цепная реакция) и секвенирование ДНК. Эти методы позволяют установить состав и структуру нуклеиновых кислот и выявить различия между разными видами и организмами.
| Вид нуклеиновой кислоты | Функции | Свойства |
|---|---|---|
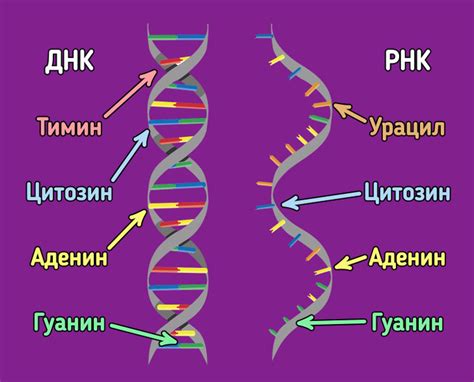
| ДНК | Хранение генетической информации | Двуцепочечная структура, состоящая из четырех нуклеотидов: аденин (A), тимин (T), гуанин (G) и цитозин (C) |
| РНК | Трансляция генетической информации, регуляция экспрессии генов | Одноцепочечная структура, состоящая из четырех нуклеотидов: аденин (A), урацил (U), гуанин (G) и цитозин (C) |
Сравнительные исследования свойств различных видов нуклеиновых кислот позволяют лучше понять и объяснить различия в строении и функциях этих молекул, а также их роль в генетике и эволюции организмов.