Периодическая система Д.И. Менделеева представляет собой удивительное устройство, в котором каждый элемент занимает свое место в зависимости от своих физических и химических свойств. В простой таблице симметрично располагаются элементы, а также указываются их атомные номера, атомные массы и другие характеристики. Одна из интересных особенностей периодической системы - это изменение окислительных свойств элементов при переходе от одного периода к другому.
Окислительные свойства элементов определяют их способность вступать в химические реакции с другими веществами и передавать электроны. В периоде, с первого элемента до последнего, это свойство увеличивается. Такое поведение обусловлено изменением структуры атомов и электронной конфигурации, а также влиянием ядерного заряда.
На каждом следующем периоде количество энергетических уровней, на которых находятся электроны, увеличивается. Таким образом, внешний энергетический уровень, на котором находятся электроны валентной оболочки, становится все более удаленным от ядра. Количество электронов на этом уровне также увеличивается, что обуславливает большую вероятность потери или передачи электронов при химических реакциях. Следовательно, в периоде окислительные свойства элементов увеличиваются.
Окислительные свойства в периоде

Основной фактор, влияющий на окислительные свойства элементов в периоде, – изменение электронной конфигурации от элемента к элементу. В периоде электронная конфигурация изменяется за счет добавления электронов во внешние энергетические уровни, что влияет на взаимодействие элементов с другими веществами.
Более высокие элементы в периоде обычно имеют большее число электронов во внешней оболочке, что делает их более электроотрицательными. Это означает, что они имеют большую способность принимать электроны от других веществ и окислять их. Такие элементы обладают сильными окислительными свойствами и, как правило, реагируют с другими веществами, отбирая у них электроны.
С другой стороны, меньшие элементы в периоде обычно имеют меньшее число электронов во внешней оболочке, что делает их более электроположительными. Они имеют меньшую способность принимать электроны от других веществ и окислять их. Такие элементы обладают слабыми окислительными свойствами и, как правило, реагируют с другими веществами, отдавая свои электроны.
Таким образом, окислительные свойства элементов в периоде увеличиваются по мере увеличения атомного номера. Более высокие элементы в периоде имеют большую электроотрицательность и способность окислять другие вещества, в то время как меньшие элементы имеют меньшую электроположительность и склонность к восстановлению во время химических реакций.
Влияние электронной конфигурации

Окислительные свойства элементов в периоде зависят от их электронной конфигурации. Как известно, электроны в атомах размещаются на энергетических уровнях и подуровнях. В периоде количество энергетических уровней увеличивается, что влияет на окислительные свойства элементов.
При движении по периоду, от левой стороны к правой, количество электронов в внешнем энергетическом уровне увеличивается. Это означает, что в периоде увеличивается число электронов, способных участвовать в химических реакциях. В результате элементы в конце периода обладают большей активностью и сильнее проявляют окислительные свойства.
Также электронная конфигурация внешнего энергетического уровня, а именно количество электронов на нем и их распределение по подуровням, влияет на окислительные свойства элементов. Например, элементы с полностью заполненными или полностью пустыми подуровнями внешнего энергетического уровня обычно проявляют меньшую активность и слабее окисляются или вступают в реакции окисления.
Таким образом, электронная конфигурация элементов влияет на их окислительные свойства в периоде. Увеличение количества энергетических уровней и наличие особой электронной конфигурации внешнего энергетического уровня делают элементы в конце периода более активными и сильнее окислителями.
Тенденции в периоде
Расположение химических элементов в периоде таблицы химических элементов проявляет определенные тенденции в их окислительных свойствах. Окислительность элемента может быть определена по его способности передавать или принимать электроны во время химических реакций.
Окислительные свойства элементов в периоде обычно увеличиваются при движении отлева направо. Это связано с увеличением зарядов ядра и уменьшением атомного радиуса. Чем выше заряд ядра и меньше атомный радиус, тем сильнее притяжение ядра к электронам внешнего энергетического уровня, и тем легче элементу отдавать электроны.
Исключением в этой тенденции являются элементы периода, которые находятся непосредственно перед блоком переходных элементов. Данные элементы имеют галогеноподобные свойства и проявляют самую высокую окислительную способность в своем периоде. Например, фтор (F) и хлор (Cl) являются сильными окислителями и способны отдавать электроны другим элементам.
| Элемент | Окислительность |
|---|---|
| Литий (Li) | Низкая |
| Бериллий (Be) | Низкая |
| Бор (B) | Низкая |
| Углерод (C) | Средняя |
| Азот (N) | Высокая |
| Кислород (O) | Высокая |
Таким образом, тенденции в окислительных свойствах увеличиваются в периоде таблицы химических элементов, и эти свойства связаны с зарядом ядра и атомным радиусом элемента.
Увеличение энергии ионизации
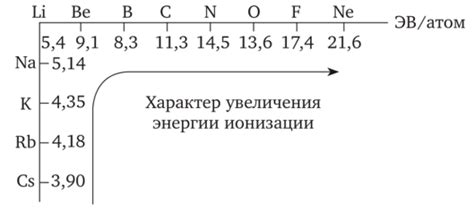
В периоде таблицы химических элементов атомные радиусы обычно уменьшаются по мере приближения к правому краю периода. Это связано с увеличением заряда ядра и с уменьшением числа электронных оболочек. Увеличение заряда ядра приводит к притяжению электронов к ядру с большей силой, что сказывается на энергии ионизации элементов.
Энергия ионизации - это энергия, необходимая для удаления одного электрона из атома в основном состоянии. Она измеряется в электрон-вольтах (эВ) или килоджоулях на моль (кДж/моль). Чем больше энергия ионизации, тем больше энергии требуется для удаления электрона, и тем "сильнее" окислительные свойства элемента.
В периоде энергия ионизации обычно увеличивается по мере приближения к правому краю периодической системы. Это связано с уменьшением атомных радиусов и увеличением заряда ядра. С уменьшением радиуса электрон попадает ближе к ядру, что приводит к усилению силы притяжения между ними и, соответственно, к увеличению энергии ионизации.
Увеличение энергии ионизации в периоде связано с тем, что с каждым последующим элементом число электронов внешней оболочки остается неизменным, а заряд ядра увеличивается. Поэтому энергия ионизации возрастает вдоль периода отлево направо.
| Элемент | Энергия ионизации (эВ) |
|---|---|
| Литий (Li) | 5.39 |
| Бериллий (Be) | 9.32 |
| Бор (B) | 8.30 |
| Углерод (C) | 11.26 |
| Азот (N) | 14.53 |
Как видно из приведенной таблицы, энергия ионизации увеличивается для каждого последующего элемента в периоде. Это свидетельствует о том, что окислительные свойства элементов усиливаются в периоде. Высокая энергия ионизации делает элементы менее активными в химических реакциях, так как большая энергия требуется для удаления электрона и образования положительно заряженного иона.
Межатомные взаимодействия
В периоде элементы расположены в порядке возрастания атомного номера, что приводит к изменению химических свойств. Повышение окислительных свойств в периоде можно объяснить межатомными взаимодействиями.
Период начинается с атома щелочного металла, у которого наибольший радиус и наименьшую электроотрицательность. Чем ближе элемент к концу периода, тем меньше его радиус и больше электроотрицательность. Эти свойства влияют на способность элемента принимать или отдавать электроны.
Уменьшение атомного радиуса и увеличение электроотрицательности приводят к усилению протяженности заряда ядра и увеличению притяжения к нему внешних электронов. Это делает элементы периода более электроотрицательными и склонными к окислению. Окислительные свойства элементов в периоде возрастают, поскольку их электроотрицательность растет, что способствует принятию электронов от других атомов.
Благоприятные условия для окисления

Периоды в таблице Менделеева предоставляют благоприятные условия для проявления окислительных свойств элементов.
Окисление – это процесс, при котором элемент теряет электроны, а оксигенные диофлориды, которым отдали электроны, называются оксигенными веществами. В периоде элементы приобретают потенциал для окисления, так как их энергия окисления возрастает.
В периоде увеличивается заряд ядра, что делает его притягательной силой сильнее. Это приводит к тому, что остовные электроны и атомные радиусы становятся меньше. Меньший размер атома позволяет более эффективно взаимодействовать с другими элементами и принимать участие в окислительных реакциях.
Кроме того, чем больший номер периода, тем больше энергии необходимо для отрыва электрона от его атома. Это делает элементы в периоде более активными окислителями, так как они будут более энергично взаимодействовать с другими веществами и отдавать свои электроны.
Таким образом, благодаря увеличивающейся энергии окисления и уменьшающемуся атомному радиусу, элементы в периоде обладают усиленными окислительными свойствами.
Электроотрицательность элементов
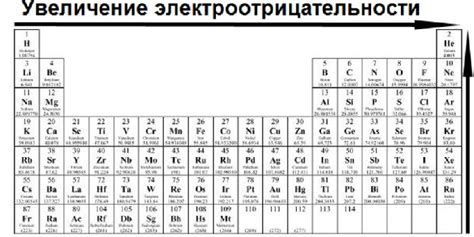
По мере движения в периоде от левого к правому краю таблицы Менделеева электроотрицательность элементов возрастает. Это связано с увеличением заряда ядра атома и количества электронов внешней электронной оболочки.
Наибольшую электроотрицательность обладают вещества, состоящие из атомов с маленьким радиусом и высоким зарядом ядра, таких как галогены (фтор, хлор, бром, йод) и кислород. Они проявляют сильную тенденцию к принятию электронов от других элементов и, следовательно, имеют высокую окислительную способность.
В то же время, элементы с низкой электроотрицательностью, например, щелочные металлы (литий, натрий, калий), обладают высокой способностью отдавать свои электроны другим элементам. Поэтому они выступают как сильные восстановители и имеют высокую восстановительную способность.
Электроотрицательность элементов играет важную роль в химических реакциях, особенно в оксидно-восстановительных реакциях. Большинство химических реакций связаны с передачей или обменом электронов между элементами. Электроотрицательность элементов определяет, какие элементы будут восстанавливаться, а какие будут окисляться в реакции.
Таким образом, увеличение электроотрицательности элементов в периоде играет существенную роль в определении их окислительных свойств.