Молярная масса является одним из важных показателей, который позволяет определить массу одного моля вещества. Этот параметр играет ключевую роль в многих химических расчетах и является неотъемлемой частью таблицы Менделеева. Зная молярную массу, можно определить количество вещества по массе и наоборот.
Но как же найти молярную массу с помощью таблицы Менделеева? Все гораздо проще, чем кажется! Достаточно знать атомную массу каждого элемента и уметь считать!
Сначала нужно найти все атомы вещества, из которых оно состоит, в таблице Менделеева. Каждый элемент имеет свой знак (символ), например С (углерод) или O (кислород), а также атомную массу. Затем, нужно умножить атомную массу каждого элемента на его количество. Полученные значения нужно сложить между собой. В итоге мы получим молярную массу данного вещества, выраженную в г/моль или кг/моль.
Зачем нужно знать молярную массу?

Также знание молярной массы помогает проводить расчеты стехиометрических соотношений между различными веществами, что позволяет определить, сколько вещества необходимо для проведения химической реакции или какое количество продукта получится в результате реакции.
Молярная масса является одним из ключевых понятий в химической термодинамике, поскольку позволяет расчитывать энергию реакции и другие важные физические и химические параметры.
Таким образом, знание молярной массы позволяет химикам установить не только состав и свойства веществ, но и проводить различные химические расчеты, что имеет важнейшее значение при изучении и испытании различных химических соединений и реакций.
Практическое применение

- Вычислять количество вещества по заданной массе или наоборот.
- Определять степень чистоты и примесей вещества.
- Расчеты при проведении химических реакций и определении реакционных условий.
- Планировать и проводить лабораторные эксперименты.
Например, при изучении реакций взаимодействия различных веществ, знание молярной массы позволяет определить соотношение реагентов и продуктов реакции. Это же знание используется в промышленности при разработке и проектировании производства различных химических соединений.
Молярная масса также является важным параметром для проведения точных расчетов и анализа в химической лаборатории. Она используется для определения количества вещества, объема реакционной смеси и подбора оптимальных условий реакции.
Таким образом, знание молярной массы позволяет проводить различные расчеты и операции в химической практике, способствуя более точным и эффективным исследованиям и процессам производства.
Роль в химических реакциях

Молярная масса химического вещества играет важную роль в химических реакциях. Она определяет количество вещества, которое участвует в реакции, а также позволяет провести расчеты по количеству вещества и массе.
Когда химические вещества вступают в реакцию, они соединяются или разлагаются, образуя новые вещества. В химических формулах веществ указывается их молярное количество, которое исчисляется в молях. Молярная масса позволяет преобразовать массу вещества в количество вещества и наоборот.
Для проведения расчетов по химическим реакциям, необходимо знать молярные массы всех веществ, участвующих в реакции. Таблица Менделеева предоставляет информацию о молярных массах различных химических элементов и соединений, что облегчает проведение расчетов.
Таким образом, зная молярную массу веществ, можно определить количество вещества, необходимое для реакции, а также рассчитать массу продукта реакции. Это позволяет химикам планировать и оптимизировать процессы химического взаимодействия, а также контролировать качество продукции.
| Химический элемент | Символ | Атомная масса |
|---|---|---|
| Водород | H | 1.00784 г/моль |
| Кислород | O | 15.999 г/моль |
| Углерод | C | 12.01 г/моль |
| Азот | N | 14.007 г/моль |
Как узнать молярную массу вещества?

Для определения молярной массы вещества можно использовать таблицу Менделеева. В таблице Менделеева указаны атомные массы элементов, выраженные в атомных единицах массы (u), которые равны 1/12 массы атома углерода-12.
Чтобы вычислить молярную массу вещества, необходимо сложить массы атомов, входящих в его молекулу или единицу формулы, умноженные на их количества. Например, для вычисления молярной массы воды (H2O), необходимо сложить массы двух атомов водорода (H) и одного атома кислорода (O).
Молярная масса вещества выражается в г/моль и обозначается символом "М". Молярная масса воды (H2O) равна примерно 18,02 г/моль. Это означает, что один моль воды имеет массу 18,02 г.
Зная молярную массу вещества, можно легко пересчитывать массу вещества в граммах в количество вещества в молях и наоборот, используя соотношение:
масса вещества (г) = количество вещества (моль) × молярная масса (г/моль)
Пример: Если масса вещества равна 36 г, а молярная масса равна 18 г/моль, то количество вещества будет равно 2 моля.
Определение молярной массы

Для простого вещества, молярная масса совпадает с атомной массой элемента. Например, молярная масса кислорода равна 16 г/моль, так как атомный масса кислорода равна 16 а.е.м. (атомных единиц массы).
Для сложного вещества, молярная масса рассчитывается путем сложения масс элементов с учетом их количества в формуле вещества. Например, для определения молярной массы воды (H2O), нужно учесть массу двух атомов водорода (1 а.е.м.) и массу одного атома кислорода (16 а.е.м.). Таким образом, молярная масса воды будет равна 18 г/моль.
Молярная масса является важной характеристикой вещества, так как она позволяет определить количество вещества в молях, зная его массу, и наоборот. Это особенно полезно при проведении реакций и рассчете количества вещества, участвующего в реакции.
Для нахождения молярной массы вещества по таблице Менделеева необходимо найти атомную массу каждого элемента, указанного в формуле вещества, и сложить их, умножив на соответствующие коэффициенты.
Используя таблицу Менделеева, определение молярной массы становится быстрым и простым процессом.
Использование таблицы Менделеева

Чтобы узнать молярную массу элемента, нужно найти его атомную массу в таблице Менделеева. Атомная масса указана на каждой ячейке таблицы и является числом с точностью до десятых или сотых долей грамма на моль. На основе атомной массы, можно легко вычислить молярную массу.
Для примера, рассмотрим элемент кислород (O) с атомной массой 16,00 г/моль. Чтобы найти молярную массу кислорода, нужно взять значение атомной массы и добавить описание единицы измерения (г/моль). В результате получим молярную массу кислорода, равную 16,00 г/моль.
Таким образом, таблица Менделеева позволяет быстро и просто определить молярную массу химического элемента. Просто найдите атомную массу нужного элемента в таблице и добавьте единицу измерения.
Примеры расчета молярной массы
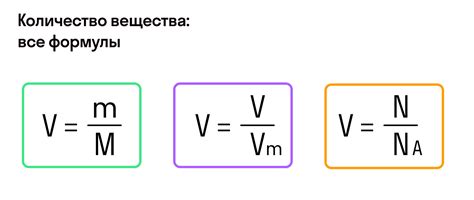
Давайте рассмотрим несколько примеров расчета молярной массы различных веществ, используя информацию из таблицы Менделеева.
Пример 1: Рассчитаем молярную массу воды (H2O). Из таблицы Менделеева мы знаем, что атом водорода (H) имеет атомную массу 1,01 г/моль, а атом кислорода (O) имеет атомную массу 16,00 г/моль. Учитывая, что в молекуле воды содержатся два атома водорода и один атом кислорода, суммируем массы атомов: 2 x 1,01 + 1 x 16,00 = 18,02 г/моль. Получаем, что молярная масса воды равна 18,02 г/моль.
Пример 2: Рассчитаем молярную массу глюкозы (C6H12O6). Из таблицы Менделеева мы знаем, что атом углерода (C) имеет атомную массу 12,01 г/моль, а атом водорода (H) имеет атомную массу 1,01 г/моль, а атом кислорода (O) имеет атомную массу 16,00 г/моль. Учитывая, что в молекуле глюкозы содержится 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, суммируем массы атомов: 6 x 12,01 + 12 x 1,01 + 6 x 16,00 = 180,18 г/моль. Получаем, что молярная масса глюкозы равна 180,18 г/моль.
Пример 3: Рассчитаем молярную массу кальция (Ca). Из таблицы Менделеева мы знаем, что атом кальция (Ca) имеет атомную массу 40,08 г/моль. Следовательно, молярная масса кальция равна 40,08 г/моль.
Таким образом, используя информацию из таблицы Менделеева, мы можем легко и быстро рассчитать молярную массу различных веществ.