Молярная масса - это фундаментальная характеристика химического элемента или химического соединения, позволяющая нам определить количество вещества, измеряемое в молях. Знание молярной массы является важным фактором в химии, поскольку она позволяет проводить точные расчеты, включая составление реакционных уравнений, определение массы соединений и определение степени реакции.
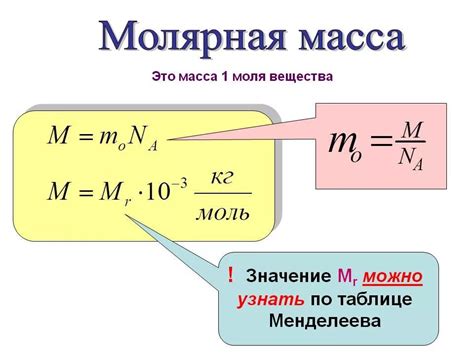
Определение молярной массы вещества можно получить, обратившись к таблице Менделеева, которая содержит информацию о всех химических элементах, их атомным номерам, символам и атомным массам. Для расчета молярной массы нужно умножить атомный вес каждого элемента на количество атомов данного элемента в молекуле соединения, а затем сложить все полученные значения. Таким образом, таблица Менделеева является незаменимым инструментом для проведения таких расчетов в химических исследованиях и процессах.
Знание молярной массы вещества позволяет получить более точные результаты и более полное понимание его химических свойств и реакций. Кроме того, молярная масса служит основой для проведения лабораторных исследований, разработки новых материалов и лекарств, а также в промышленности и научных исследованиях в области химии и физики. Поэтому знание молярной массы вещества является неотъемлемой частью ряда научных дисциплин и является ключевым фактором в понимании химических процессов.
Молярная масса вещества: что это и зачем нужна таблица Менделеева?
Для определения молярной массы используется таблица Менделеева - систематическая группировка химических элементов по возрастающей атомной массе. В таблице Менделеева указываются атомные массы элементов, которые выражаются в атомных единицах (универсальная атомная массовая единица - атом углерода-12).
Если известна химическая формула вещества, то молярная масса может быть рассчитана путем сложения масс атомов, входящих в эту формулу. Например, молярная масса воды (H2О) равна сумме масс двух атомов водорода и одного атома кислорода.
Зная молярную массу вещества, можно провести ряд различных расчетов, таких как количество вещества в граммах или количество атомов. Молярная масса также является важным показателем при проведении химических реакций и формулировании химических уравнений.
Как узнать молярную массу вещества в таблице Менделеева?
Как определить атомную массу элемента? Для этого необходимо обратиться к таблице Менделеева и найти атомную массу нужного элемента. Атомная масса указана в верхней части квадрата, относящегося к данному элементу. Обычно атомная масса представлена числом с десятичной точкой. Например, атомная масса углерода равна 12,01 а.е.м., а атомная масса кислорода равна 16,00 а.е.м.
Если вещество содержит несколько атомов разных элементов, то для определения молярной массы необходимо суммировать атомные массы всех атомов, участвующих в реакции. Например, для определения молярной массы СО2 (диоксид углерода) нужно сложить атомные массы атома углерода и двух атомов кислорода: 12,01 а.е.м + 16,00 а.е.м + 16,00 а.е.м = 44,01 а.е.м.
Важно помнить, что для расчета молярной массы вещества необходимо знать его химическую формулу и количество атомов каждого элемента в этой формуле. Только при наличии всех необходимых данных можно точно определить молярную массу вещества.
Что такое молярная масса и как она определяется?

Молярная масса определяется путем суммирования атомных масс всех атомов в молекуле вещества. Для определения молярной массы химических элементов используется таблица Менделеева, где приведены атомные массы элементов.
Для определения молярной массы химических соединений нужно сначала выяснить химическую формулу вещества. Затем суммируются массы всех атомов в молекуле, умноженные на их количество. Например, для определения молярной массы воды (H2O), нужно сложить массы двух атомов водорода и одного атома кислорода.
Молярная масса вещества имеет единицу измерения - г/моль. Это позволяет сравнивать массу различных веществ на молекулярном уровне и проводить расчеты в химических реакциях. Также молярная масса является важной величиной при проведении расчетов в стехиометрии.
Зачем нужно знать молярную массу вещества?

Один из основных применений молярной массы в химии - рассчет стехиометрических задач. Зная молярные массы реагирующих веществ, можно определить их количество, которое требуется для реакции. Также молярная масса позволяет рассчитывать массовые доли вещества в химических соединениях.
Измерение молярной массы также позволяет определить концентрацию растворов, что важно для различных аналитических методов. Знание молярной массы вещества также необходимо для расчета физических свойств вещества, таких как плотность или вязкость.
Благодаря молярной массе мы можем проводить сравнительные анализы состава и свойств различных веществ. Также молярная масса позволяет определить степень очистки вещества, его процентное содержание в смесях и многое другое.
Таким образом, знание молярной массы вещества важно не только для химиков, но и для многих других областей науки и промышленности. Точные данные о молярной массе позволяют проводить более точные расчеты, определять физические и химические свойства вещества и применять их в различных практических целях.
Методы вычисления молярной массы по таблице Менделеева
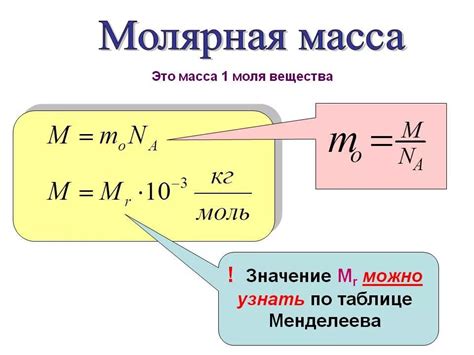
Существует несколько методов вычисления молярной массы по таблице Менделеева. Рассмотрим два наиболее распространенных метода:
1. Суммирующий метод:
Для вычисления молярной массы вещества суммируются массы атомов всех его элементов. Массы атомов указаны в таблице Менделеева в атомных единицах, известных как атомная массовая единица – аму. После суммирования полученная масса преобразуется в граммы, умножив на молярную массовую константу, равную 1 г/моль.
2. Использование химической формулы:
Химическая формула вещества показывает, из каких элементов оно состоит и в каком количестве.
Первым шагом необходимо определить химическую формулу вещества. Затем можно использовать суммирующий метод, суммируя массы атомов соответствующих элементов.
Важно отметить, что вещество может иметь различные формы (аллотропные модификации) и изотопы, что приводит к различным значениям молярной массы вещества.
Вычисление молярной массы по таблице Менделеева является фундаментальной задачей в химии и играет важную роль в проведении лабораторных исследований, анализе веществ и разработке новых материалов.
Примеры вычисления молярной массы с помощью таблицы Менделеева
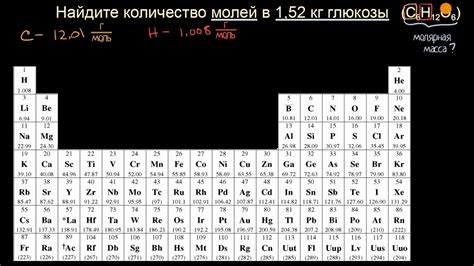
$$n = \frac{m}{M},$$
где $n$ - количество вещества (в молях), $m$ - масса вещества (в граммах) и $M$ - молярная масса вещества.
Чтобы найти молярную массу вещества, нужно взглянуть на таблицу Менделеева и найти атомы элементов, из которых состоит данное вещество. Например, у нас есть основной компонент воды – молекулярный кислород (O) и два атома водорода (H). В таблице Менделеева мы находим, что молярная масса кислорода равна приблизительно 16 г/моль, а молярная масса водорода составляет около 1 г/моль.
Теперь мы можем посчитать молярную массу воды: $$M = 2 \cdot M_H + M_O = 2 \cdot 1 + 16 = 18 \, г/моль,$$ где $M_H$ и $M_O$ - молярные массы водорода и кислорода соответственно.
Таким образом, молярная масса воды составляет 18 г/моль. Это означает, что в одном моле воды содержится 18 г молекул, а количество воды в молях можно получить, разделив массу вещества на молярную массу:
$$n = \frac{m_{воды}}{M_{воды}}.$$
Например, если у нас есть 36 г воды, тогда $$n = \frac{36}{18} = 2 \, моль \, воды.$$
Таким образом, таблица Менделеева помогает ученым и студентам определить молярную массу вещества и провести различные расчеты, связанные с количеством вещества и массой.
Почему важно знать молярную массу вещества в химии?
Во-первых, зная молярную массу, легче определить массовое количество вещества в единицах измерения, таких как граммы, килограммы и т.д. Это позволяет производить точные расчеты при синтезе или анализе состава химических соединений.
Во-вторых, молярная масса вещества играет важную роль в области стехиометрии - науки, изучающей количественные отношения между реагентами и продуктами химической реакции. Зная молярные массы их веществ, можно определить, какая масса продуктов образуется при заданном количестве реагентов и наоборот.
Кроме того, молярная масса вещества позволяет определить мольные соотношения в реакции, что особенно важно для расчета эквивалентов веществ и состава смесей.
Однако, знание молярной массы не только помогает в решении теоретических задач, но и имеет практическое применение. Например, при проведении лабораторных исследований необходимо точно измерять массу вещества, и знание его молярной массы позволяет определить нужное количество материала.
Следовательно, знание молярной массы вещества является необходимым для понимания и изучения основ химии, и является важным инструментом в решении практических задач в этой области.
Как использовать молярную массу для решения химических задач?

Молярная масса позволяет установить соотношение между массой вещества и его количеством. Она используется при расчете массы вещества, молярного состава соединений, количества вещества в реакциях и других химических задачах.
Для решения химических задач с использованием молярной массы необходимо знать следующие шаги:
- Найти молярную массу нужного вещества в таблице Менделеева.
- Подставить найденные значения в нужные формулы и уравнения.
- Выполнить расчеты, используя соотношения между массой, количеством вещества и молярной массой.
Например, для расчета количества вещества в реакции можно использовать следующую формулу:
количество вещества (в молях) = масса вещества (в г) / молярная масса вещества (в г/моль)
Таким образом, зная молярную массу вещества и его массу, можно легко определить количество вещества.
Использование молярной массы помогает химикам проводить точные расчеты, определять пропорции веществ в реакциях и понимать химические процессы на молекулярном уровне. Она является неотъемлемой частью изучения химии и имеет широкое применение в химических исследованиях и промышленности.
Важно помнить, что для решения химических задач необходимо иметь точные и надежные данные о молярной массе вещества, которые можно найти в таблице Менделеева или других источниках информации.