Углерод – один из самых распространенных элементов в живой и неживой природе. Его особые свойства позволяют ему образовывать огромное количество соединений, причем с разными элементами и в разных степенях окисления. Ответ на вопрос, почему углерод имеет разную валентность, можно найти, изучив его электронную структуру и особенности химической связи.
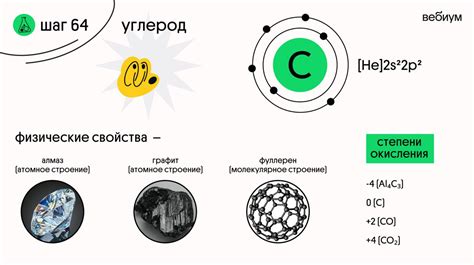
Углерод имеет атомный номер 6, что говорит о том, что у него 6 электронов. В электронной оболочке углерода находятся два электрона в первой оболочке и четыре электрона во второй оболочке. Эта особенность электронной конфигурации углерода позволяет ему образовывать четыре связи с другими атомами. Именно этот факт лежит в основе разнообразия соединений, в которых углерод играет важную роль.
Четырехвалентность углерода обеспечивается его способностью образовывать ковалентные связи с другими атомами. В ковалентной связи углерод делит свои электроны с атомами других элементов, образуя общую область электронной плотности. Это позволяет углероду формировать стабильные молекулы и обладать большим числом соединений.
Валентность углерода: особенности и значение

Валентность углерода определяет сколько связей он может образовывать с другими атомами. Она связана с количеством электронов, находящихся во внешней электронной оболочке углерода. Обычно углерод имеет четыре связи, что позволяет ему образовывать стабильные соединения.
| Валентность углерода | Примеры соединений |
|---|---|
| Валентность 4 | Метан (CH4), этан (C2H6), пропан (C3H8), бутан (C4H10) |
| Валентность 3 | Этен (C2H4), пропен (C3H6), бутен (C4H8) |
| Валентность 2 | Спирт метиловый (CH3OH), этанол (C2H5OH), эфир метиловый (CH3OCH3) |
| Валентность 1 | Формальдегид (CH2O), метанол (CH3OH), метанамин (CH3NH2) |
Значение валентности углерода заключается в его способности образовывать различные органические соединения. Благодаря этому углерод является основой жизни на Земле, так как в его соединениях заключены такие важные компоненты, как углеводы, жиры, белки и ДНК.
Понимание валентности углерода является важным фундаментальным знанием в химии органических соединений, которое позволяет предсказывать и объяснять структуру и свойства различных органических соединений.
Влияние электронной конфигурации на валентность углерода
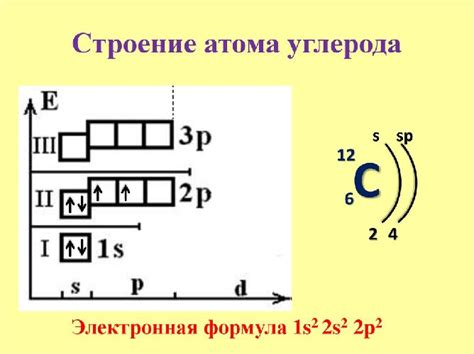
Основная электронная конфигурация углерода - 1s2 2s2 2p2. Она подразумевает наличие углерода валентных 2s- и 2p-орбиталей, способных образовывать связи с другими атомами. При этом, количество занятых и доступных углероду электронных орбиталей будет определять его валентность.
Если углерод образует четыре связи, его валентность будет равна 4. Это характерно для многих соединений углерода, таких как метан (CH4), этилен (C2H4) и многих других. В этих случаях, углерод использует все свои доступные электроны, чтобы установить максимальное количество связей с другими атомами.
Однако, в некоторых случаях, валентность углерода может быть отлична от 4. Например, в соединении углерода с водородом в метаноле (CH3OH), углерод образует только три связи. В этом случае, углерод выступает валентным соединением и его валентность равна 3.
Причина изменения валентности углерода в таких соединениях связана с доступностью его электронных орбиталей. В метаноле, одна из п-орбиталей углерода занята парой электронов, связанных с атомом кислорода. Поэтому, углерод может установить только три связи с атомами водорода.
Таким образом, электронная конфигурация углерода определяет его валентность в различных соединениях. Изменения в валентности могут быть связаны с доступностью электронных орбиталей и количеством связей, которые углерод может образовать с другими атомами.
Основные причины изменения валентности углерода

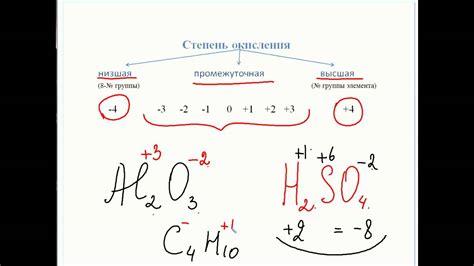
Углерод, химический элемент с атомным номером 6, может образовывать различные соединения с другими элементами, и его валентность может быть различной. Валентность углерода определяет количество связей, которые атом углерода может образовывать с другими атомами. Основные причины изменения валентности углерода могут быть связаны с электронной конфигурацией атома и его стремлением к достижению более стабильного состояния.
Одной из основных причин изменения валентности углерода является электронная конфигурация атома. Атом углерода имеет 4 электрона в своей внешней оболочке, что делает его способным к образованию четырех связей с другими атомами. Однако, в некоторых случаях углерод может образовывать меньшее количество связей, например, две или три. Это происходит, когда атом углерода образует двойную или тройную связь с другим атомом, в то время как оставшиеся электроны находятся в свободной форме или сформированы с другими атомами в молекуле.
Второй причиной изменения валентности углерода является его стремление к достижению более стабильного состояния. Углерод может образовывать различные соединения, включая органические и неорганические, и его валентность может изменяться в зависимости от природы и свойств атомов, с которыми он образует связи. Например, в органических соединениях углерод обычно имеет валентность 4, образуя четыре одинарные связи с другими атомами углерода или других элементов. Однако, в некоторых случаях углерод может образовывать двойные или тройные связи, чтобы достичь более стабильного состояния, например, в случае алкенов или алкинов.
Таким образом, основные причины изменения валентности углерода связаны с электронной конфигурацией атома и его стремлением к достижению более стабильного состояния. Понимание этих причин позволяет более глубоко изучать и объяснять свойства и реакционную способность углерода и его соединений.
Валентность углерода в органических соединениях
Углерод имеет 4 валентных электрона, что позволяет ему образовывать до четырех химических связей. Это основное объяснение большой разнообразности органических соединений. Углерод может образовывать одинарные, двойные и тройные связи с другими атомами углерода, а также с атомами других элементов, таких как водород, кислород, азот и многие другие.
Одна из особенностей углерода в органической химии - его способность образовывать цепочки и кольца, что приводит к образованию сложных структур. Также стоит отметить, что углерод может образовывать связи с собой, образуя так называемые аллиловые и ароматические соединения.
Валентность углерода в органических соединениях может быть изменена в результате различных химических реакций, таких как окисление, восстановление, ацилирование и другие. Изменение валентности углерода позволяет получать новые соединения и модифицировать их свойства.
Таким образом, валентность углерода играет ключевую роль в органической химии, определяя его способность образовывать химические связи и формировать сложные структуры соединений.
Валентность углерода в неорганических соединениях
В некоторых неорганических соединениях углерод проявляет валентность +2, например, в оксидах углерода, таких как оксид углерода(II) (CO), оксид углерода(IV) (CO2) и других. В этих соединениях углерод образует две ковалентные связи с кислородом.
Однако, в большинстве неорганических соединений углерод проявляет валентность +4. Классическим примером является диоксид углерода(CO2), в котором углерод образует две ковалентные связи с двумя атомами кислорода.
Также углерод может проявлять валентность +3, например, в некоторых неорганических боратах. В боратах углерод образует три ковалентные связи с тремя атомами бора.
Валентность углерода в неорганических соединениях определяется его электронной конфигурацией и строением молекулы. Как правило, углерод имеет четыре свободных электронных пары, которые он может использовать для образования ковалентных связей.
Изучение валентности углерода в неорганических соединениях позволяет лучше понять его химические свойства и способности к реакциям. Это важно для разработки новых материалов и применения углерода в различных отраслях науки и техники.
Углеродные соединения с переменной валентностью

Углерод может образовывать соединения с переменной валентностью, где число связей между атомами углерода может быть различным. Это связано с тем, что углерод имеет четыре электрона в валентной оболочке, и он может образовывать до четырех связей с другими атомами. Однако, в некоторых случаях, углерод может образовывать связи с большим числом атомов.
Примером углеродных соединений с переменной валентностью являются полиатомные ионы. Например, ион карбокатиона (C+) имеет трехвалентный углерод, так как образует три связи с другими атомами. Этот ион часто встречается в органических соединениях, таких как метан, этилен и пропан.
Также вариантом соединений с переменной валентностью могут быть ароматические соединения, в которых углерод образует связи с шестью атомами, образуя стабильное кольцо. Примером такого соединения является бензол, состоящий из шести атомов углерода, образующих кольцо с альтернированными двойными связями.
Углеродные соединения с переменной валентностью имеют важное значение в органической химии, так как они обладают различными свойствами и могут применяться в различных сферах, ам и в медицине, пищевой промышленности, энергетике и многих других областях.
Значение валентности углерода в химической промышленности
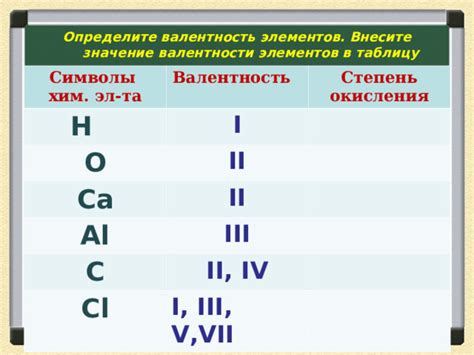
Валентность углерода, являющегося основным элементом органической химии, имеет огромное значение в химической промышленности. Углерод представлен в различных веществах, начиная от простых соединений, таких как углеродная кислота и метан, и заканчивая сложными полимерами, включая пластик и синтетические волокна.
Одной из причин такого широкого распространения углерода в промышленности является его способность образовывать множество связей с другими атомами, благодаря своей валентности. Углерод обладает четырьмя электронами во внешнем энергетическом уровне, что позволяет ему образовывать до четырех ковалентных связей с другими атомами, а также образовывать различные структурные конфигурации. Это делает углерод уникальным элементом для создания разнообразных органических соединений и материалов.
В химической промышленности важное значение имеют такие соединения углерода, как метан, этилен и ацетилен. Метан, с помощью ковалентных связей карбонового атома, служит основным источником энергии в процессах генерации тепла и электроэнергии. Этилен используется в производстве пластиков и синтетических волокон, благодаря способности углерода образовывать двойные связи. Ацетилен, образованный путем гидрогенизации углеродного газа, выполняет роль сырья в производстве органических соединений, включая ацетон, который используется в процессе синтеза пластика и растворителей.
Благодаря уникальной способности углерода образовывать различные типы связей и конфигураций, он является неотъемлемым элементом химической промышленности. Разработка и использование органических соединений на основе углерода позволяют создавать широкий спектр материалов и продуктов, от пластиков и лекарств до синтетических волокон и косметических средств. Таким образом, понимание и учет валентности углерода играют важную роль в развитии и производстве современных химических продуктов и материалов.



