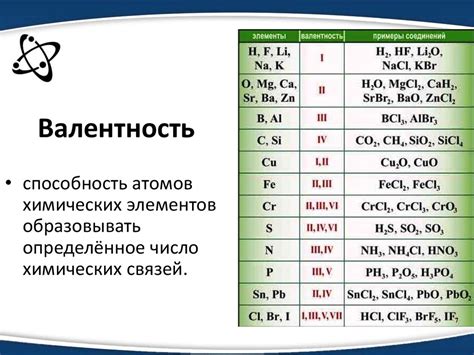
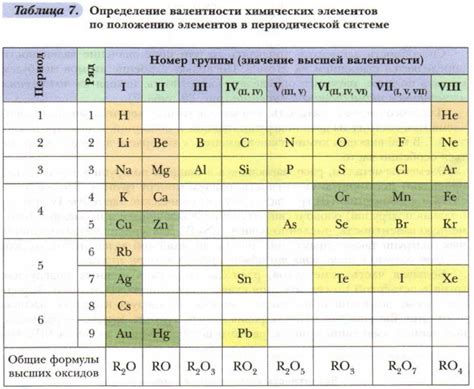
Валентность водорода – один из самых важных параметров химического элемента, определяющий его способность образовывать химические связи с другими элементами. Примечательно то, что валентность водорода всегда равна единице, что делает его уникальным и фундаментальным компонентом множества химических соединений.
Почему валентность водорода равна единице? Этот вопрос интересует многих химиков и ученых. Ответ лежит в строении атома водорода и его электронной оболочке. Атом водорода состоит из одного протона и одного электрона, притягиваемых друг к другу силой электростатического взаимодействия. Электрон в валентной оболочке атома водорода является единственным исключением, поскольку он обладает наименьшей электроотрицательностью, что делает его способным образовывать лишь одну химическую связь с другими элементами.
Валентность водорода, равная единице, позволяет ему образовывать различные соединения с элементами таблицы химических элементов. Он может образовывать ионные или ковалентные связи, в результате которых образуются водородные соединения. Например, водород может образовывать воду (H2O) путем образования двух ковалентных связей с атомами кислорода.
Следует отметить, что реактивность водорода, обеспечиваемая его валентностью равной единице, делает его важным компонентом во многих отраслях промышленности и науки. Он используется в производстве аммиака, водородных топливных элементов, а также в космической промышленности и лабораторных исследованиях.
Объяснение валентности водорода

Валентность водорода, равная одному, может быть объяснена на основе его строения и электронной конфигурации.
Водород является первым элементом в периодической системе элементов и имеет один электрон в своем единственном энергетическом уровне. Он также имеет одну энергетическую оболочку, которая может содержать две электронные структуры энергии.
Водород стремится завершить свою электронную оболочку, чтобы достичь стабильности, а это может быть сделано путем образования ковалентных связей с другими элементами. Валентность элемента определяется его способностью образовывать связи и участвовать в химических реакциях.
Таким образом, вальцентность водорода равна единице, поскольку он может образовывать только одну ковалентную связь, делая его наиболее стабильным, когда его электронная оболочка заполнена одним электроном.
Водород также имеет особую роль в химии, так как он может образовывать водородные связи, которые более слабы, чем ковалентные связи, но важны для структуры и свойств многих соединений.
Что такое валентность водорода?
Валентность водорода всегда равна единице, что означает, что атом водорода способен образовывать только одну связь. Водород - самый простой элемент в таблице химических элементов, и его атом содержит только один электрон.
Из-за своей низкой валентности, водород может образовывать различные типы химических связей. Он может образовывать ковалентные связи, в которых электроны делятся между атомами, или ионные связи, в которых водородный атом отдает свой электрон другому атому.
Валентность водорода также играет важную роль в химических реакциях. Благодаря своей высокой реактивности и способности образовывать связи с различными элементами, водород может участвовать во многих химических реакциях и образовывать разнообразные соединения.
Формула валентности водорода
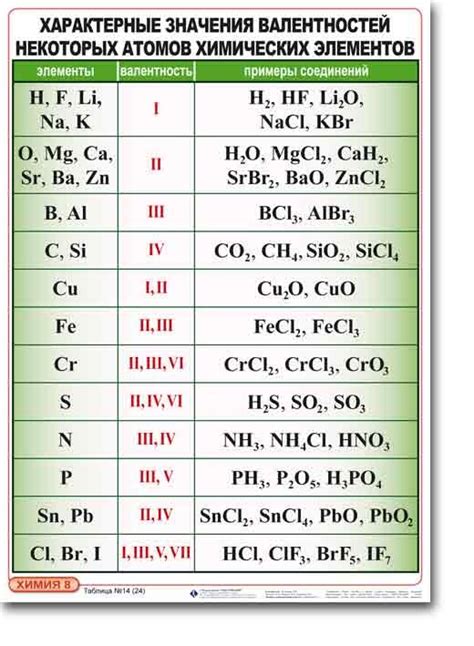
Валентность водорода равна единице и определяется атомарной структурой этого химического элемента. Формула валентности водорода может быть записана следующим образом: H+. Здесь H обозначает атом водорода, а + указывает на положительный заряд атома.
Валентность водорода равна единице потому, что он имеет только один электрон в своей валентной оболочке. Этот электрон может быть передан другому атому, чтобы образовать химическую связь. Водород может образовывать связи с различными химическими элементами, такими как кислород, углерод или азот, и при этом сохранять свою валентность.
Формула валентности водорода позволяет установить, сколько связей может водород образовать и с какими элементами. Она является основой для понимания множества химических реакций, в которых участвует водород. Благодаря своей валентности, водород играет важную роль в образовании молекул и соединений, а также во многих биохимических процессах в живых организмах.
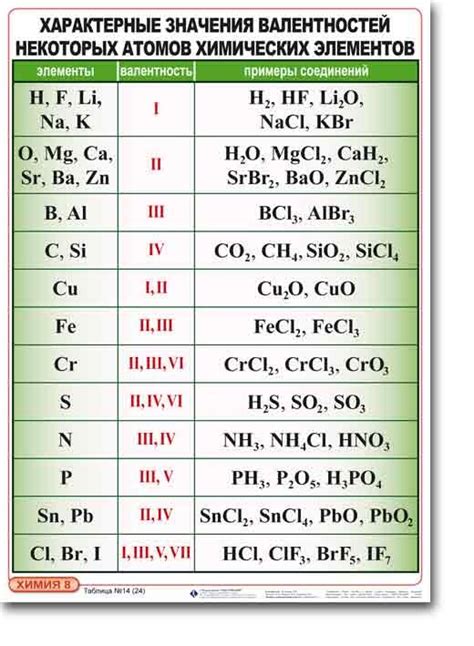
Валентность водорода в разных соединениях
Валентность водорода имеет важное значение, так как водород может образовывать разнообразные соединения с другими элементами и играет важную роль во многих химических реакциях.
Валентность водорода может быть проиллюстрирована на примере следующих соединений:
1. Вода (H2O)
В молекуле воды каждый атом водорода образует одну связь с атомом кислорода. Таким образом, валентность водорода в воде составляет единицу.
2. Аммиак (NH3)
В молекуле аммиака три атома водорода образуют связи с атомом азота. Каждая связь формируется между одним атомом водорода и атомом азота, поэтому валентность водорода в аммиаке также равна единице.
3. Метан (CH4)
В молекуле метана четыре атома водорода образуют связи с атомом углерода. Каждая связь формируется между одним атомом водорода и атомом углерода, поэтому валентность водорода в метане также равна единице.
Таким образом, валентность водорода всегда остается постоянной и равной единице во всех его соединениях.
Валентность водорода в органических соединениях
Водород может образовывать одну связь с другими элементами, например, с углеродом, кислородом или азотом. Такие связи называются одиночными связями и представляются в химических формулах органических соединений символом H.
Одиночные связи водорода с другими элементами могут быть учтены при анализе структуры органического соединения и определении его формулы. Водородные атомы могут также участвовать в образовании водородных связей, которые способствуют стабилизации структуры молекулы.
Изучение валентности водорода в органических соединениях является важным аспектом органической химии и помогает в понимании свойств и реакций органических соединений. Валентность водорода, равная единице, определяет его химическую активность и способность образовывать связи с другими элементами.
Комплексация валентности водорода

Комплексация валентности водорода играет важную роль во многих химических реакциях и процессах. Она позволяет стабилизировать молекулы, изменяя их реакционную способность. Кроме того, водород может служить переносчиком электронов или протонов в реакциях окисления и восстановления.
Процессы комплексации валентности водорода происходят в различных сферах, таких как катализ, электрохимия, фотохимия и биохимия. Водородные связи играют важную роль в формировании трехмерной структуры белков и нуклеиновых кислот, что определяет их функциональные свойства.
Более того, комплексация валентности водорода может приводить к образованию "мостиков" между молекулами, что создает уникальные свойства веществ. Например, водородные мостики между молекулами воды обуславливают ее высокую температуру плавления и кипения, а также свойства растворителя для многих веществ.
Таким образом, комплексация валентности водорода играет ключевую роль в химических и биологических процессах, обеспечивая формирование сложных структур и определяя различные свойства веществ. Понимание и изучение этого процесса являются важной задачей современной науки.
Значение валентности водорода в химических реакциях
Валентность водорода играет важную роль во многих химических реакциях. Водород может присоединяться к другому атому, отдавая свой один электрон. Такая реакция называется редокс-реакцией и является одной из основных форм химических превращений.
Водородное соединение, полученное в результате реакции водорода с другим элементом, называется гидридом. Гидриды водорода широко используются в промышленности и научных исследованиях. Например, гидриды водорода используются в процессе водородации органических соединений для получения жидких топлив и водорода.
Валентность водорода также определяет его возможность образовывать кислоты и основания. Водородные кислоты содержат H+ и играют важную роль во многих биологических и химических процессах. Водородные основания содержат группу OH- и также являются важными веществами в химических реакциях.
Благодаря своей валентности водород может играть разнообразные роли в химических реакциях, образуя различные соединения и принимая участие в разнообразных процессах. Понимание значения и свойств валентности водорода позволяет лучше понять и объяснить множество химических явлений и процессов.
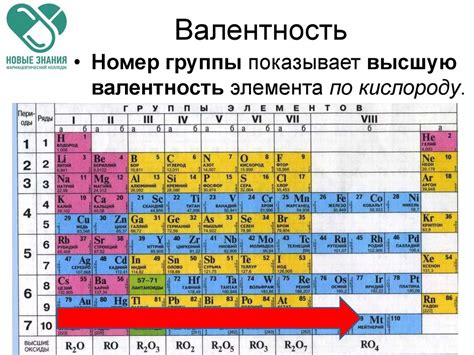
Как определить валентность водорода?
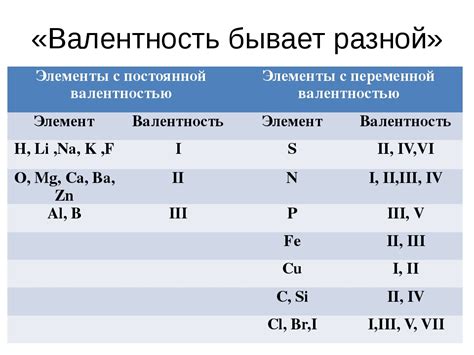
В случае водорода, его электронная конфигурация состоит только из одного электрона, расположенного на одной оболочке. Таким образом, водород может отдать свой единственный электрон и приобрести положительный заряд, равный единице. В этом случае, валентность водорода равна единице.
Однако, валентность водорода может изменяться в зависимости от вещества, с которым он образует химическую связь. Например, водород может принимать электроны, чтобы образовать воду (H2O), где его валентность составляет -1. В других соединениях водорода, таких как метан (CH4) или аммиак (NH3), его валентность также может быть разной.
Таким образом, валентность водорода зависит от контекста и вещества, с которым он взаимодействует. Это свойство водорода делает его уникальным и важным элементом в химических реакциях и образовании различных соединений.
Валентность водорода равна единице по нескольким основным причинам:
- Водород обычно образует соединения, в которых каждый атом водорода присоединяется к одному атому другого элемента. Это может быть элементарный газовый водород H2, вода H2O или множество других соединений.
- Водород может образовывать лишь одну ковалентную связь, так как у него только один электрон в внешней оболочке. Поэтому он может образовывать только одну связь с другими атомами.
- У водорода наименьший атомный радиус, что позволяет ему легко проникать в пространство между атомами других элементов, образуя ковалентные связи.
Особенности валентности водорода делают его уникальным элементом в химии и играют важную роль во многих химических реакциях и процессах.