Поверхностное натяжение - это явление, которое проявляется в том, что поверхность воды находится под напряжением и имеет свойства, схожие с поверхностью растянутой пленки. Этот феномен проявляется благодаря особенностям молекулярной структуры воды и ее химических свойств.
Вода состоит из двух атомов водорода и одного атома кислорода, которые связаны между собой ковалентной связью. Данный состав воды обусловливает ее полярность, то есть наличие положительных и отрицательных зарядов. Молекулы воды взаимно притягиваются и образуют связи посредством водородных связей, вызывая поверхностное натяжение.
Поверхностное натяжение воды также связано с силой когезии - способностью молекул притягиваться друг к другу. Молекулы, находящиеся воды внутри жидкости, окружены соседними молекулами, их силы тяготения друг к другу примерно равны и не создают дополнительного напряжения.
Воду отличает высокое поверхностное натяжение из-за

Молекулы воды состоят из атомов водорода и атома кислорода, соединенных ковалентной связью. Водородные атомы обладают положительным зарядом, а атом кислорода - отрицательным. Это приводит к образованию диполя воды - молекула имеет положительный и отрицательный полярные заряды.
В результате такого распределения зарядов водные молекулы образуют силы взаимодействия, называемые водородными связями. Водородный атом одной молекулы взаимодействует с кислородным атомом соседней молекулы воды. Эти силы являются достаточно сильными, что приводит к образованию плотного и стабильного слоя на поверхности воды - поверхностного натяжения.
Это свойство имеет много практических применений. Высокое поверхностное натяжение воды позволяет некоторым организмам, например, насекомым, перемещаться по ее поверхности. Также благодаря поверхностному натяжению вода способна формировать капли, что является основой для многих технических устройств и технологий.
Таблица 1. Сравнение поверхностного натяжения воды с другими жидкостями:
| Вещество | Поверхностное натяжение, Н/м |
|---|---|
| Вода | 0.0728 |
| Масло | 0.02 |
| Ртуть | 0.48 |
Как видно из таблицы, поверхностное натяжение воды значительно выше, чем у других жидкостей. Это свойство делает воду особенно интересной и полезной во многих сферах нашей жизни.
Присутствующие в ней водородные связи
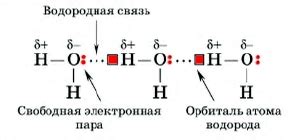
В молекуле воды каждый атом кислорода связан с двумя атомами водорода. При этом электроны находятся ближе к атому кислорода, что создает разность зарядов между атомами. Эта разность зарядов приводит к образованию положительно заряженной области около водородных атомов и отрицательно заряженной области около атома кислорода.
В результате такого строения молекулы воды, она обладает способностью образовывать водородные связи. Приближение молекул воды вызывает притяжение между положительно заряженным водородом одной молекулы и отрицательно заряженным кислородом соседней молекулы. Таким образом, возникают водородные связи, которые удерживают молекулы воды вместе.
Водородные связи являются очень сильными, и их энергия составляет около 20 кДж/моль. Именно эта энергия обеспечивает высокое поверхностное натяжение воды. Молекулы воды на поверхности жидкости испытывают асимметричную силу притяжения со стороны окружающих молекул, что приводит к образованию пленки поверхностного натяжения.
На поверхности воды молекулы организуются таким образом, чтобы максимально использовать количество водородных связей. Именно поэтому вода имеет высокое поверхностное натяжение, которое, в свою очередь, определяет множество ее физических и химических свойств.
Поверхностное натяжение воды обусловлено

Поверхностное натяжение воды обусловлено двумя факторами. Во-первых, молекулы воды имеют дипольные свойства, то есть они обладают положительным зарядом на одной стороне и отрицательным на другой. Это создает электростатические силы притяжения между молекулами и способствует образованию когерентной поверхности.
Во-вторых, водные молекулы обладают способностью образовывать водородные связи друг с другом. Водородные связи - это силы притяжения между молекулами, обусловленные взаимодействием между положительно заряженным водородом и отрицательно заряженной кислородной группой в соседних молекулах. Эти связи удерживают молекулы воды вместе и создают прочное поверхностное натяжение.
Оба этих фактора - дипольные свойства и водородные связи - создают силы, которые притягивают молекулы внутрь жидкости и сокращают их поверхность до минимального размера. Это объясняет почему капли воды на поверхности образуют сферическую форму и почему их поверхность подтягивается к центру.
Идеальной геометрической структурой молекул

Главной особенностью молекул воды является то, что ее атомы располагаются не по прямой линии, а образуют углы около 104.5 градуса. Такая нелинейная геометрия молекулы воды обусловлена присутствием свободных электронных пар кислорода.
Эти свободные электронные пары делают молекулу воды полярной, что означает неравномерное распределение электронной плотности в молекуле. В результате образуется положительный заряд у атомов водорода и отрицательный заряд у атома кислорода.
Такая полярность молекулы воды приводит к явлению, известному как водородные связи. Водородные связи возникают между положительно заряженными атомами водорода одной молекулы и отрицательно заряженным атомом кислорода соседней молекулы.
Эти слабые водородные связи объединяют молекулы воды в структуру, называемую «сетью водородных связей». Эта сеть обладает высокой прочностью и сопротивлением разрыву, что и является причиной высокого поверхностного натяжения воды.
Каждая молекула воды в сети водородных связей удерживается сразу несколькими водородными связями, образуя структуру, похожую на трехмерную сетку. Это приводит к возникновению сил притяжения между молекулами и поддержанию молекул воды на поверхности, формируя высокое поверхностное натяжение.
Высокое поверхностное натяжение является

Молекулы воды являются полярными, что означает, что у них есть положительный и отрицательный заряды. В результате такой полярности, молекулы воды притягиваются друг к другу очень сильно, образуя межмолекулярные водородные связи.
Эти водородные связи обеспечивают высокую силу притяжения между молекулами воды на поверхности жидкости. В результате этого, молекулы воды на поверхности образуют плотный слой, который держится вместе благодаря водородным связям. Именно из-за этого плотного слоя поверхностное натяжение воды является достаточно высоким.
Высокое поверхностное натяжение воды имеет много важных физических и биологических последствий. Например, оно обеспечивает поддержание формы капли и делает возможным возникновение капель на поверхности. Кроме того, высокое поверхностное натяжение воды играет ключевую роль во многих биологических процессах, таких как транспорт веществ через клеточные мембраны и поведение насекомых, способных ходить по воде.
Причиной капиллярного действия
Вода обладает высоким поверхностным натяжением, что означает, что ее поверхность сопротивляется разрушению. Это свойство объясняется способностью молекул воды притягиваться друг к другу и образовывать связи, известные как водородные связи. В результате этого образуются сильные силы, удерживающие молекулы воды на поверхности.
При наличии капилляра, такого как тонкая трубка или пористый материал, вода начинает подниматься внутри капилляра. Это происходит из-за капиллярного давления, которое обусловлено силой когезии молекул воды и силой адгезии между молекулами воды и стенками капилляра.
Капиллярное действие играет важную роль в растениях, позволяя воде подниматься от корней к верху растения через сосуды. Оно также может быть использовано в различных технологических процессах, включая капиллярный подъем жидкостей в микросистемах и фильтрацию через пористые материалы.