Водород - самый легкий и простой элемент в периодической системе химических элементов. Его положение в системе долгое время вызывало споры и дебаты среди ученых. В основе этого спора лежал вопрос о том, в какую группу следует классифицировать водород - в первую (группа I) или седьмую (группа VII).
С одной стороны, водород, имея одну электронную оболочку, как группа I, образует лишь одно связующее валентное электронное облако. В этом случае, он может легко отдавать или принимать электроны, чтобы образовать катионы или анионы, соответственно.
С другой стороны, водород, благодаря своему водородному связующему донорному эффекту, проявляет себя как элемент, образующий ковалентные связи, как элемент группы VII. Он располагается в периодической системе рядом с галогенами, такими как хлор, бром, йод.
Таким образом, водород можно справедливо считать элементом, который не соответствует четкой классификации в одну группу. Он имеет свойства и связи с элементами из обеих групп, что делает его уникальным и отличным от остальных элементов в системе. Это подчеркивает важность и сложность классификации элементов в периодической системе.
Расположение водорода в периодической системе
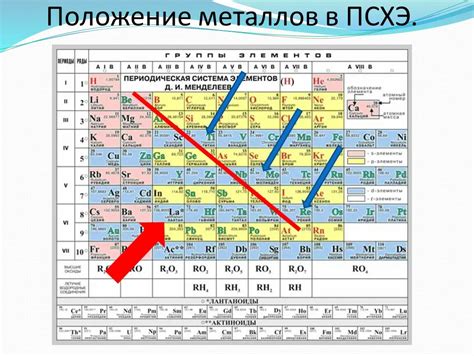
Наиболее распространенная система расположения элементов в периодической таблице основана на их электронной конфигурации. Согласно этой системе, водород располагается в 1 группе периодической системы, наряду с литием, натрием и другими щелочными металлами. Вода и многие другие соединения водорода являются щелочными.
Однако, существует и другая система расположения водорода. Некоторые ученые предлагают расположить его в 7 группе периодической таблицы, наравне с галогенами, такими как фтор и хлор. Эти ученые аргументируют свое мнение тем, что водород может образовывать ион H-, идентичный галогенным ионам. Однако, большинство современных периодических таблиц все же располагают водород в 1 группе.
Таким образом, вопрос о расположении водорода в периодической системе остается открытым. Оба подхода имеют своих сторонников и противников, исходя из различных факторов и свойств водорода. Но независимо от его точного местоположения, водород остается уникальным и важным элементом, широко используемым в различных отраслях научных и технических исследований.
Будущее положение водорода в периодической системе

Это предложение основано на сходстве химических свойств водорода с группой галогенов: фтор, хлор, бром и йод. Водород может образовывать ковалентные связи с другими элементами, аналогично галогенам.
При таком положении в периодической системе водород будет быть расположен рядом с элементами, имеющими сходные химические свойства. Это сделает периодическую систему более логичной и удобной для изучения и применения.
Однако, такое перемещение водорода в 7 группу вызывает обсуждения и споры среди ученых. Другие ученые полагают, что водород должен оставаться в 1 группе, так как его особое положение отражает его уникальные химические и физические свойства.
В дальнейшем будущем может произойти изменение положения водорода в периодической системе, однако это требует дальнейших исследований и научных обсуждений.
Место водорода в периодической системе сейчас

Основной аргумент, подтверждающий такую классификацию, - это наличие у водорода одной валентной электронной оболочки, что делает его похожим на металлы первой группы, такие как литий, натрий и калий. Кроме того, свойства водорода, такие как высокая теплопроводность и электропроводность, также подтверждают его принадлежность к первой группе.
В то же время водород совершенно уникален среди элементов первой группы. Например, он образует одноименный газ, который не имеет цвета, запаха и вкуса. Кроме того, водород имеет наименьшую плотность среди всех элементов, что делает его легче других металлов первой группы.
Водород также играет важную роль в химии и биологии. Он является основным исходным материалом для синтеза большого количества органических соединений, а также является частью молекул воды и жизненно важных молекул, таких как ДНК и белки.
Таким образом, хотя водород обладает некоторыми сходствами с элементами первой группы, его уникальные свойства и роль в химии и биологии делают его отдельным и особенным элементом, занимающим свое собственное место в периодической системе.
Аргументы за расположение водорода в 1 группе
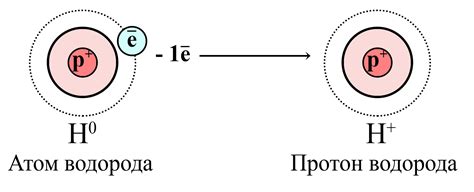
Существует несколько аргументов, подтверждающих расположение водорода в 1 группе периодической системы:
1. Схожие электронные конфигурации: Водород имеет всего один электрон, которое находится в единственной энергетической оболочке. Это схоже с орбитальным строением элементов 1 группы (алкалийных металлов), которые также имеют один электрон в своей внешней энергетической оболочке.
2. Аналогичные химические свойства: Водород образует ионы H+ со схожими химическими свойствами, как и ионы алкалийных металлов (например, Na+, K+). Это связано с тем, что водород и алкалийные металлы имеют одну валентную электронную оболочку, и оба элемента стремятся отдать или получить один электрон для достижения стабильной октетной конфигурации.
3. Сходство в связывании с галогенами: Водород может образовывать связи с галогенами (например, с хлором) аналогично алкалийным металлам. Этот факт также говорит в пользу принадлежности водорода к 1 группе элементов.
Однако стоит отметить, что вопрос о точном расположении водорода в периодической системе остается открытым и подлежит дальнейшему исследованию.
Аргументы за расположение водорода в 7 группе
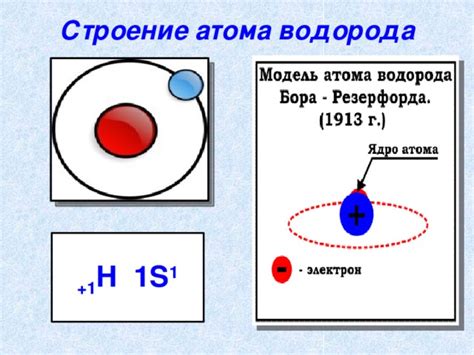
1. Сходство валентных электронных конфигураций: Водород имеет только один электрон, который находится в 1s орбитали. Это структурное сходство с элементами 7 группы, такими как фтор, хлор и бром, которые также имеют один валентный электрон в 2p подуровней.
2. Аналогия в химическом поведении: Водород образует аналогичные химические соединения с элементами 7 группы. Например, водород может образовывать одноэлектронные химические связи, что аналогично образованию комплексов соединений элементов 7 группы с другими элементами.
3. Тенденция к химическому окислению: Водород обычно проявляет химическую активность аналогичную активности элементов 7 группы. Он может претерпевать окисление, образуя ион водорода H+ или гидридные ионы, что подтверждает его сходство с другими элементами данной группы.
4. Температурное поведение: Водород, как и элементы группы 7, обладает особыми свойствами при низких температурах. Он может образовывать водородные связи, подобные водородным связям, которые образуются между молекулами элементов 7 группы (например, между молекулами воды).
5. Место в электронной конфигурации: Водород имеет электрон в 1s орбитали, что соответствует электронной конфигурации в 7 группе периодической системы, где внешними электронами также являются электроны 2p подуровня.
6. Структурное сходство с элементами 7 группы: Водород обладает сходством со свойствами элементов 7 группы. Например, физические свойства водорода (такие как плотность, точка кипения и плавления) аналогичны свойствам элементов 7 группы.
Химическое поведение водорода и его связь с группами
Химические свойства водорода определяются преимущественно водородной связью – силой притяжения, которая образуется между водородом и другими атомами элементов. Водород образует водородные связи как с электроотрицательными элементами из 7 группы периодической системы, так и с металлами из 1 группы, но при этом его поведение больше схоже с 7 группой.
Электроотрицательность элемента является важным фактором, определяющим химическое поведение и способность к образованию химических связей. Водород – элемент сравнительно низкой электроотрицательностью, поэтому при контакте с элементами, обладающими большей электроотрицательностью, он образует водородные связи. Водородные связи схожи с ковалентными связями и обладают значительной силой.
Водород образует водородные связи с элементами из 7 группы, такими как кислород, сера, хлор, азот и др. Вода (H2O) и сероводород (H2S) – это примеры соединений водорода с элементами из этой группы. Эти соединения обладают особыми химическими свойствами, такими как способность к образованию водородных связей, растворимость в воде и кислотность.
Водород также способен образовывать связи с элементами 1 группы периодической системы – щелочными металлами, такими как литий, натрий, калий и др. Однако, химическое поведение водорода в этой группе отличается от активных металлов. Например, водород не образует с ними ионные связи, как это делают другие элементы 1 группы. Вместо этого, он образует ковалентные связи, подобно связям водородной группы элементов 7 группы.
Таким образом, химическое поведение водорода связано как с элементами 1 группы, так и с элементами 7 группы периодической системы. Однако, его особенности строения и низкая электроотрицательность делают его химическое поведение более схожим с элементами 7 группы. Водородные связи, образуемые водородом, обладают важной ролью в химии и влияют на свойства вещества, образуемого этим элементом.
История дебатов о расположении водорода в периодической системе

Первоначально, согласно старым моделям, водород был размещен в группе 1 периодической таблицы, так как имеет одну валентную электрон и может образовывать ион водорода H+. Однако, с развитием атомной теории исследователи начали сомневаться в правильности такого расположения.
Существовало несколько причин, почему ученые предлагали переместить водород в группу 7. Во-первых, водород имеет возможность образовывать бинарные соединения с галогенами (например, водород и хлор образуют соляную кислоту), что является характерной особенностью элементов 7 группы. Во-вторых, у некоторых изотопов водорода есть спиновый изомеризм, что согласуется с характеристиками элементов 7 группы. Наконец, водород может образовывать сильные связи с многими элементами, что также типично для элементов 7 группы.
Тем не менее, были и аргументы в пользу размещения водорода в группе 1. Например, водород может образовывать ионы H- и иметь отрицательную степень окисления, что характерно для элементов 1 группы. Кроме того, водород имеет только один электрон нижнего уровня энергии, что также свидетельствует в пользу его размещения в 1 группе.
В результате, долгие годы не было консенсуса относительно правильного расположения водорода. Современные модели периодической системы предлагают размещение водорода в группе 1, но включение его и в 7 группу может быть также оправданным.
Таким образом, дебаты о расположении водорода в периодической системе продолжаются, и ученые продолжают исследовать его свойства и характеристики, чтобы лучше понять его место в таблице элементов.
Влияние физических свойств водорода на выбор его местоположения в периодической системе

Одно из самых важных физических свойств водорода - его массовое число. Водород относится к группе элементов, у которых массовое число равно 1. Благодаря этому свойству, водород занимает первое место в периодической системе. Его атом имеет наименьшую массу среди всех химических элементов, что делает его ключевым компонентом многих органических и неорганических соединений.
Другое важное физическое свойство водорода - его электроотрицательность. Водород имеет электроотрицательность близкую к нулю, что делает его похожим на элементы 1 группы периодической системы - щелочные металлы. Вместе с тем, у водорода есть сходства с элементами 7 группы - галогенами, связанными с его способностью образовывать ковалентные связи с другими элементами.
Кроме того, водород обладает специфическим физическим свойством - возможностью существования в трех агрегатных состояниях. При низких температурах и высоком давлении, водород превращается в твердое вещество. При увеличении температуры и/или снижении давления, он переходит в жидкое состояние, а затем - в газообразное. Это свойство водорода отличает его от других элементов в периодической системе и также влияет на его местоположение.
Совокупность этих физических свойств делает водород уникальным элементом, не легко классифицируемым в одну из групп периодической системы. Однако, обычно водород относится к 1 группе периодической системы, исходя из его электроотрицательности и общей химической активности.