Водород – уникальный элемент, который, несмотря на свои особенности, находится в группе летучих несжимаемых газов, в 7 группе таблицы Менделеева. Зачастую его положение вызывает вопросы у даже опытных химиков.
Чтобы понять, почему водород находится в 7 группе, необходимо обратить внимание на его электронную конфигурацию. Водород состоит из одного протона в ядре атома и одного электрона, движущегося по орбите. Таким образом, водород имеет только одну валентную электронную оболочку. Это является основой его классификации в 7 группе.
Тем не менее, это положение водорода нельзя считать окончательным и строгим, так как в различных источниках и системах классификации он может иметь разное положение.
Кроме того, водород имеет некоторые химические свойства, которые делают его уникальным. В то время как большинство элементов в группе 1 имеют сходные химические свойства, водород отличается своей неполярной химической связью. Это объясняет его способность образовывать соединения с многими элементами, включая металлы и неметаллы.
Водород – элемент 7 группы: особенности и позиция в таблице Менделеева
Одной из особенностей водорода является его способность образовывать соединения как с металлами, так и с неметаллами. Например, с неметаллами он образует кислоты, а с металлами – гидриды. Это свойство делает водород ключевым компонентом многих соединений и соединительных звеньев химических реакций.
Позиция водорода в таблице Менделеева вызывает много обсуждений и споров среди ученых. В основе споров лежит вопрос о том, можно ли классифицировать водород как металл или неметалл. С помощью различных методов определения химической активности и физических свойств водорода удалось выявить его связи и характеристики, которые не полностью вписываются в рамки классификации металлов и неметаллов. Это порождает теории о том, что водород является уникальным и отдельным классом элементов.
Не смотря на споры о позиции, водород в целом признается частью 7 группы. Это объясняется также его атомной структурой, электронной конфигурацией и поведением в химических реакциях. Вместе с тем, ученые продолжают проводить исследования и обсуждать возможность переклассификации водорода на основе новых данных о его свойствах и взаимодействиях.
Химические свойства водорода и его необычный химический состав

Один из самых ярких признаков водорода - его высокая реакционная способность. Взаимодействуя с другими элементами, водород образует целый ряд соединений, таких как вода (H2O), аммиак (NH3), метан (CH4) и многие другие. Более того, водород может быть отрицательным и положительным ионом, вступать в реакции окисления и восстановления, что делает его универсальным химическим агентом.
Однако наиболее необычным свойством водорода является его химический состав. В отличие от других элементов, водород состоит всего из одного протона и одного электрона. Такая простота химического состава делает водород одним из основных строительных блоков вселенной. Благодаря своей низкой массе и высокому содержанию в звездах, водород является основным источником энергии во многих ядерных реакциях.
Водород также обладает особой способностью к образованию водородных связей, которые возникают между молекулами водорода и другими атомами. Эта химическая связь обеспечивает прочность и стабильность многих органических соединений, что делает их жизненно важными для биологических систем.
Кроме того, водород имеет самую низкую плотность среди всех элементов, что делает его легким и подвижным. Это позволяет водороду распространяться по всему миру, включая атмосферу Земли. Благодаря этому распространению, водород играет важную роль во многих геохимических и экологических процессах.
Итак, несмотря на свою простоту, водород обладает уникальными химическими свойствами, которые делают его неотъемлемой частью многих жизненно важных процессов в природе. Его высокая реакционная способность, необычный химический состав и способность образовывать водородные связи делают его незаменимым элементом во многих химических и физических системах.
Атомная структура водорода и его единственное электронное облако
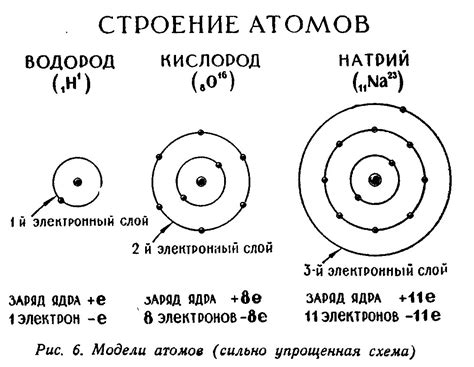
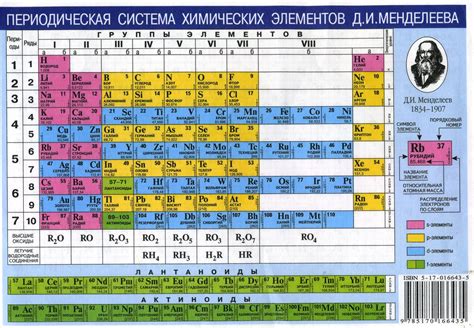
Атом водорода имеет наименьший атомный номер среди всех элементов, составляющих таблицу Менделеева. Он расположен в 1 группе и 1 периоде, что указывает на его уникальные свойства и положение в периодической системе.
Атомная структура водорода состоит из одного протона в ядре и одного электрона, который образует единственное электронное облако вокруг ядра. Такая простая атомная структура делает водород самым простым элементом в периодической системе.
Электронное облако водорода описывается квантовой механикой, которая представляет его в виде распределения вероятностей обнаружить электрон в различных точках пространства. Наиболее вероятное место нахождения электрона называется электронной оболочкой. Электронное облако для водорода имеет форму сферы с ядром в центре.
Водород также имеет особое значение в химии, поскольку является основным строительным блоком всех остальных элементов. Он образует соединения с другими элементами, атомы которых стремятся заполнить свои электронные оболочки и достичь устойчивой конфигурации. Водород-ион или просто протон является основным ионом в кислотно-щелочных реакциях и других важных химических процессах.
Физические свойства водорода и его газообразное состояние при комнатной температуре

Одним из основных физических свойств водорода является его газообразное состояние при комнатной температуре и давлении. Водород не имеет окраски и запаха, он является легким газом, обладающим низкой плотностью.
Водород обладает высокой теплопроводностью и электропроводностью. Он также отличается от других газов своей низкой вязкостью и повышенной реакционной активностью.
Водород может образовывать различные соединения, включая воду (H2O) и аммиак (NH3), что делает его важным компонентом во многих химических реакциях.
Интересный факт: при охлаждении водородной газовой смеси до очень низких температур (-259,16 °C) водород переходит в жидкое состояние. Это состояние называется жидкий водород (ЛВ). Жидкий водород используется в ракетостроении и других высокотехнологичных отраслях.
Водород как важный источник энергии и возможности его использования

Одним из главных способов использования водорода в качестве источника энергии является процесс горения. При сгорании водорода образуется вода и выделяется большое количество тепловой энергии. Благодаря этому, водород может использоваться для получения электроэнергии и тепла.
Кроме того, водород может использоваться как топливо для водородных топливных элементов. Водородные топливные элементы являются эффективными источниками энергии, так как позволяют преобразовывать химическую энергию водорода прямо в электрическую энергию без выделения вредных веществ. Водородные топливные элементы могут использоваться в различных отраслях, включая автомобильную промышленность, энергетику и даже космическую индустрию.
Водород также может быть использован в процессе синтеза аммиака, который является основным компонентом для производства удобрений. Это позволяет сэкономить большое количество энергии и ресурсов, так как аммиак является одной из самых распространенных химических промышленных продукций.
Еще одним интересным направлением использования водорода является его применение в процессе синтеза металлов. Водород может использоваться в качестве редукционного агента для получения различных металлов из их соединений, что позволяет снизить энергозатраты и сделать процесс производства более экологичным.
Водород играет важную роль в современной энергетике и имеет большой потенциал для дальнейшего развития. Его использование может помочь сократить выбросы загрязняющих веществ и снизить зависимость от ископаемых источников энергии. При этом водород считается одним из самых чистых и экологически безопасных источников энергии.
Водородная связь и ее роль в химических реакциях
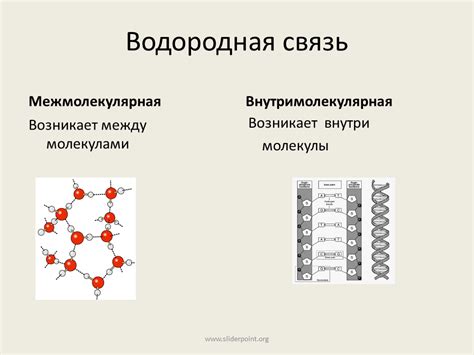
Водородная связь – это связь между атомом водорода и электроотрицательным атомом другого элемента, такими как кислород, азот, фтор и т.д. Этот тип связи образуется из-за разности электроотрицательности атомов. Атом водорода, являющийся положительно заряженным, притягивается к отрицательно заряженному атому другого элемента. Это приводит к образованию слабой связи между двумя молекулами или двумя частями одной молекулы.
Водородная связь имеет большое значение в структуре и свойствах многих веществ. Она обуславливает многие физические и химические свойства вещества, такие как температура кипения, растворимость, поверхностное натяжение и др.
Водородная связь играет ключевую роль в образовании биологических молекул, таких как ДНК и белки, где она способствует сохранению трехмерной структуры молекулы и влияет на ее функциональность.
Также, водородные связи известны своей ролью в химических реакциях, где они могут влиять на кинетику и механизмы реакций. Они могут стабилизировать промежуточные комплексы реакций и активировать молекулы для их последующего превращения.
Кроме того, водородная связь может влиять на химическую активность вещества и его взаимодействие с другими соединениями. Она может участвовать в образовании межмолекулярных сил и кластеров, что может приводить к образованию новых физических и химических свойств.
Таким образом, водородная связь является важным фактором в химии и имеет широкий спектр применений. Ее изучение позволяет лучше понять структуру и свойства вещества, а также улучшить синтез и дизайн новых материалов и соединений.
Положение водорода в таблице Менделеева и его особенности

Водород обычно располагают в первой группе, но на самом деле его положение более сложное. Связано это с тем, что водород может образовывать комплексы с другими элементами. При этом в химических реакциях он может отдавать или принимать электроны, что делает его поведение более похожим на поведение некоторых элементов семьи VIII группы.
Одной из особенностей водорода является его уникальная способность образовывать соединения с разными свойствами. Например, водород может образовывать оксиды, где он выступает в роли электроотрицательного элемента, а также соединения, где он выступает в роли электроположительного элемента.
| Свойство | Водород |
|---|---|
| Атомный номер | 1 |
| Относительная атомная масса | 1,00794 |
| Плотность | 0,08988 кг/м³ |
| Температура плавления | −259,16 °C |
| Температура кипения | −252,87 °C |
Из-за уникальных свойств водорода, его положение в таблице Менделеева вызывает дискуссии и споры среди ученых. Некоторые предлагают переместить его в последнюю группу, чтобы подчеркнуть его неметаллическую природу. В любом случае, водород остается особенным элементом, который продолжает быть объектом интереса для исследователей.