Оксиды - это неотъемлемая часть химических реакций, которые происходят в природе и в промышленности. По своей природе оксиды могут быть разных типов: кислотные, щелочные и амфотерные. В данной статье мы рассмотрим взаимодействие амфотерных и кислотных оксидов, их реакции и свойства.
Амфотерный оксид - это такой оксид, который может проявлять и кислотные, и щелочные свойства. Такие оксиды обладают способностью взаимодействовать как с кислотами, так и с основаниями. При этом, в зависимости от условий реакции, амфотерный оксид может проявлять свои кислотные или щелочные свойства.
Реакция амфотерного оксида с кислотой приводит к образованию соли и воды. При этом оксид выступает в роли основания, принимая протон от кислоты. Схематично реакция может быть представлена следующим образом:
Оксид + Кислота → Соль + Вода
Примером амфотерного оксида может служить оксид алюминия (Al2O3). Взаимодействие этого оксида с соляной кислотой (HCl) приводит к образованию хлорида алюминия (AlCl3) и воды (H2O):
Al2O3 + 6HCl → 2AlCl3 + 3H2O
С другой стороны, амфотерные оксиды также могут взаимодействовать с основаниями, проявляя свои кислотные свойства. В этом случае оксид действует как кислота, отдавая протон основанию. Такая реакция приводит к образованию соли и воды.
Взаимодействие амфотерных и кислотных оксидов имеет важное значение для понимания многих химических процессов, происходящих в природе и промышленности. Знание реакций и свойств этих оксидов позволяет контролировать и оптимизировать производство различных продуктов и материалов, а также разрабатывать новые технологии с использованием амфотерных и кислотных оксидов.
Реакции с водой

Амфотерные и кислотные оксиды могут реагировать с водой, образуя кислоты или основания. Водород (H2O), находящийся в молекуле воды, может действовать как кислота или основание в зависимости от среды.
Кислород, содержащийся в амфотерных оксидах, может присоединиться к воде, образуя кислоту. Например, оксиды серы (SO2 и SO3) реагируют с водой, образуя сульфитовую и сульфатную кислоты соответственно:
- SO2 + H2O → H2SO3
- SO3 + H2O → H2SO4
Кислород, содержащийся в кислотных оксидах, может также присоединиться к молекуле воды и образовать кислоту. Например, оксид серы (IV) (SO2) реагирует с водой, образуя сульфитовую кислоту:
- SO2 + H2O → H2SO3
Как правило, амфотерные оксиды реагируют с водой несколько слабее, чем кислотные оксиды. Однако, реакция с водой может происходить, когда амфотерный оксид находится в избытке или при использовании особых условий.
Реакция амфотерного или кислотного оксида с водой является одним из способов образования кислоты или основания, что делает эти оксиды важными для управления pH окружающей среды и поддержания химического равновесия.
Свойства амфотерных оксидов

- Диссоциация: амфотерные оксиды могут диссоциировать в водном растворе, образуя ионы. Это позволяет им проявлять как кислотные, так и щелочные свойства.
- pH-значение: амфотерные оксиды могут влиять на pH-значение раствора. В зависимости от условий реакции, они могут изменять рН в сторону щелочности или кислотности.
- Нейтрализация: амфотерные оксиды могут реагировать с кислотами и щелочами, проявляя свойства и кислоты, и щелочи. При этом образуются соли.
- Ионы: в водном растворе амфотерные оксиды расщепляются на ионы, которые могут взаимодействовать с другими веществами, образуя различные соединения.
- Амфотерность: амфотерные оксиды обладают способностью проявлять свойства и кислоты, и щелочи, что отличает их от кислотных и щелочных оксидов.
Благодаря своим свойствам амфотерные оксиды имеют широкий спектр применения. Они используются в различных отраслях промышленности, в процессе производства различных веществ и материалов. Также они являются важными компонентами в химических и реактивных процессах.
Реакции с основаниями
Кислотные оксиды обычно реагируют с основаниями, образуя соли и воду. Например, оксид серы противодействует щелочи, образуя сульфат натрия:
| Реагенты | Продукты |
|---|---|
| Оксид серы (VI) | Сульфат натрия + вода |
| SO3 | Na2SO4 + H2O |
Амфотерные оксиды также могут реагировать с основаниями, однако в этом случае продуктом является соль и вода или гидроксид металла. Например, оксид цинка взаимодействует с щелочью, образуя гидроксид цинка:
| Реагенты | Продукты |
|---|---|
| Оксид цинка | Гидроксид цинка |
| ZnO | Zn(OH)2 |
Реакции с основаниями очень важны для понимания взаимодействия амфотерных и кислотных оксидов. Они играют значительную роль в реакциях, происходящих в окружающей нас среде и применяются во многих областях, включая химическую промышленность, медицину и сельское хозяйство.
Свойства кислотных оксидов
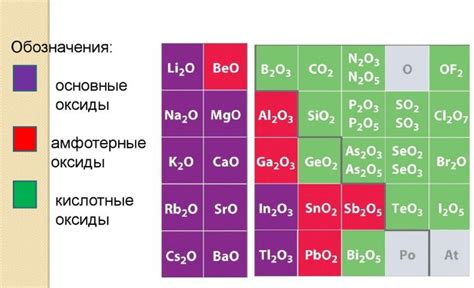
Первая группа кислотных оксидов - это оксиды неметаллов, которые взаимодействуют с водой, образуя кислоты. Примерами таких оксидов являются диоксид углерода (CO₂), диоксид серы (SO₂) и диоксид азота (NO₂). После взаимодействия с водой эти оксиды образуют соответствующие кислоты: угольную (H₂CO₃), серную (H₂SO₃) и азотистую (HNO₂) соответственно.
Вторая группа кислотных оксидов - это оксиды металлов, которые тоже обладают кислотными свойствами. Однако, в отличие от первой группы, они не взаимодействуют с водой, а образуют кислоты при соприкосновении с щелочными растворами или гидроксидами металлов. Примеры таких оксидов включают оксиды алюминия (Al₂O₃), железа (Fe₂O₃) и меди (CuO), которые при взаимодействии с натрием NaOH образуют соответствующие кислоты: алюминиевую (Al(OH)₃), железную (Fe(OH)₃) и медную (Cu(OH)₂).
Третья группа кислотных оксидов - это оксиды, которые в обычных условиях обладают кислотными свойствами и реагируют с основаниями, но при повышенных температурах могут обладать и щелочными свойствами. Примером такого оксида является оксид цинка (ZnO), который при повышенных температурах реагирует с водой, образуя щелочь - гидроксид цинка (Zn(OH)₂).
- Кислотные оксиды имеют кислотный вкус.
- Они проявляют кислотные свойства в растворах.
- Кислотные оксиды обладают низким рН (меньше 7).
- Они реагируют с основаниями, образуя соли и воду.
- Кислотные оксиды могут действовать как сточные газы и вызывать коррозию металлов.
Реакции с металлами
Амфотерные и кислотные оксиды проявляют активность при взаимодействии с металлами, образуя с ними специфические реакции.
Оксиды металлов различной активности могут взаимодействовать как с кислотными, так и с амфотерными оксидами.
Реакция с кислотными оксидами:
| Металл | Кислотный оксид | Реакция |
|---|---|---|
| Цинк | ZnO | ZnO + 2HCl = ZnCl2 + H2O |
| Алюминий | Al2O3 | Al2O3 + 6HCl = 2AlCl3 + 3H2O |
Реакция с амфотерными оксидами:
| Металл | Амфотерный оксид | Реакция |
|---|---|---|
| Цинк | ZnO | ZnO + 2NaOH = Na2ZnO2 + H2O |
| Алюминий | Al2O3 | Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O |
В результате этих реакций образуются соли и вода.
Таким образом, взаимодействие амфотерных и кислотных оксидов с металлами проявляется в образовании различных соединений, столь важных в химических реакциях и в индустрии.
Использование в промышленности
Амфотерные и кислотные оксиды широко используются в различных отраслях промышленности благодаря своим уникальным свойствам и реакционной способности.
Амфотерные оксиды используются в производстве различных материалов и веществ, таких как керамика, стекло, алюминий и некоторые минералы. Например, оксид алюминия (Al2O3) используется в производстве алюминиевых сплавов и керамических материалов, так как он обладает высокой теплостойкостью и прочностью.
Кислотные оксиды имеют широкое применение в производстве химических веществ и синтезе различных соединений. Например, оксид серы (SO2) используется в производстве серной кислоты, которая в свою очередь является важным компонентом многих химических процессов. Оксиды азота (NOx) являются важными промышленными газами и используются в производстве азотной кислоты и других химических соединений.
Кроме того, оксиды металлов широко применяются в процессах катализа, которые играют важную роль в химической и нефтегазовой промышленности. Например, оксид железа (Fe2O3) используется в процессе гидроокисления газа, чтобы увеличить его горючую способность.
Таким образом, использование амфотерных и кислотных оксидов в промышленности имеет большое значение и позволяет производить широкий спектр продукции и веществ, необходимых для современной жизни.