Хром – это химический элемент с атомным номером 24 и символом Cr. Он относится к переходным металлам и обладает множеством уникальных свойств. Одно из таких свойств – возможность образовывать соединения с разными степенями окисления.
Степень окисления элемента определяет, сколько электронов он может отдать или принять во время химической реакции. У хрома наиболее распространены две степени окисления: +3 и +6. Степень окисления +3 возникает, когда хром теряет три электрона, а степень окисления +6 – когда он теряет шесть электронов. Но почему именно степень окисления 3 так характерна для хрома?
Причина этого явления связана с электронной конфигурацией хрома. В электронной оболочке атома хрома находятся различные энергетические уровни, которые заполняются по определенным правилам. В итоге хром имеет семь электронов на самом высоком энергетическом уровне, но только три из них могут участвовать в химических реакциях. Именно поэтому у хрома наиболее распространена степень окисления +3, при которой три электрона переносятся на другие атомы.
Хром в периодической таблице

Хром обычно образует два стабильных оксида: оксид хрома(III) (Cr3+O2) и оксид хрома(VI) (Cr6+O3). Оксид хрома(III) имеет степень окисления +3, а оксид хрома(VI) – +6.
Степень окисления хрома в соединениях зависит от его электронной конфигурации. В основном состоянии, или состоянии нейтрального атома, электронная конфигурация хрома имеет вид [Ar] 3d5 4s1. Однако, при образовании соединений, электроны могут переходить между d- и s-оболочками, что приводит к изменению степени окисления.
Соединения хрома с низшей степенью окисления (Cr3+) обычно проявляют ферромагнитные свойства и служат катализаторами в различных химических реакциях. Соединения с более высокой степенью окисления (Cr6+) часто используются в качестве пигментов или добавок в керамике.
| Период | Тип элемента | Группа | Символ | Атомный номер | Относительная атомная масса |
|---|---|---|---|---|---|
| 4 | Переходный металл | 8 | Cr | 24 | 51,9961 |
Физические свойства хрома

Твёрдость: Хром является одним из самых твёрдых металлов. Его твёрдость и прочность делают его идеальным материалом для использования в производстве инструментов, таких как ножи, ножницы и пилы.
Стойкость к коррозии: Хром образует защитную пассивную оксидную пленку на поверхности, которая защищает металл от окисления и коррозии. Это делает хром незаменимым материалом для производства изделий, которые должны иметь высокую стойкость к окружающей среде, такие как автомобильные детали, бытовые приборы и мебель.
Полиморфизм: Хром обладает полиморфностью, то есть он может существовать в нескольких кристаллических формах. Это свойство позволяет хрому использоваться в производстве специальных стекол, керамики и сплавов, которые имеют уникальные физические и химические свойства.
Высокая плотность: Хром имеет высокую плотность, что позволяет использовать его в радиационных защитных материалах, электронной промышленности и других приложениях, где требуется высокая масса на единицу объема.
Магнитные свойства: Хром является ферромагнетиком при низких температурах. Он обладает слабым магнитным поляризованием при комнатной температуре, что делает его полезным материалом в магнитных системах и электротехнике.
Все эти физические свойства делают хром ценным и многосторонним металлом с широким спектром применений.
Химические свойства хрома

Хром обладает различными химическими свойствами, которые определяют его реактивность и использование в различных отраслях промышленности и научных исследованиях.
Вот некоторые химические свойства хрома:
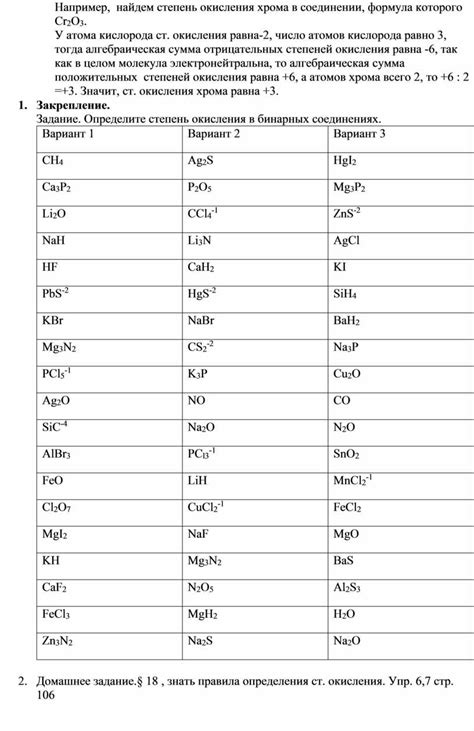
- Степень окисления: Хром имеет различные степени окисления, самая распространенная из которых - 3. Это означает, что атом хрома в соединении обладает трехвалентным зарядом. Однако, хром может также иметь степени окисления +2, +4, +5 и +6, однако они встречаются реже.
- Коррозионная стойкость: Хром обладает высокой стойкостью к окислению и коррозии. В частности, благодаря образованию оксидной пленки на поверхности металла, хром имеет высокую устойчивость к различным реагентам и окружающей среде.
- Способность образования сплавов: Хром является важным компонентом при получении различных сплавов. Сплавы хрома применяются в производстве нержавеющей стали, сплавов с алюминием, медью и никелем. Это позволяет улучшить механические свойства и стабильность материалов.
- Фармакологическое действие: Хром играет важную роль в живом организме и считается необходимым микроэлементом для метаболизма углеводов и жиров. Чрезмерное потребление или нехватка хрома может повлиять на обмен веществ и вызвать различные заболевания.
- Использование в катодном и анодном покрытии: Хром широко используется в процессах катодного и анодного покрытия поверхности различных изделий. Это позволяет улучшить их внешний вид, устойчивость к коррозии и износу.
Хром имеет много других важных химических свойств и применений, которые делают его полезным и интересным элементом для научных исследований и промышленных процессов.
Электронная конфигурация хрома
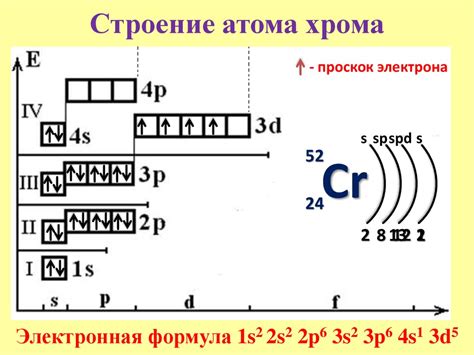
В атоме хрома имеется две энергетические оболочки: первая оболочка может вместить до 2 электронов, а вторая - до 8. Поэтому общая электронная конфигурация хрома записывается как 1s2 2s2 2p6 3s2 3p6 4s2 3d4.
Хром имеет пять электронов на энергетическом уровне 3d, что означает, что его оболочка 3d заполнена наполовину. Именно эти электроны находятся внутри атома и подвержены взаимодействию с другими элементами. Также следует отметить, что хром может иметь несколько степеней окисления, включая +2, +3 и +6. Степень окисления +3 наиболее распространена и объясняется тем, что атом хрома может отдавать три электрона из своей 3d-подоболочки.
Степень окисления в соединениях хрома
Степень окисления в соединениях хрома зависит от внешних условий и химической природы остальных элементов, с которыми он вступает в реакцию. В соединениях хрома со степенью окисления 3 хром находится в окислительном состоянии.
Соединения хрома с такой степенью окисления могут образовывать катионы Cr3+, которые являются кислотными. Кроме того, они обладают способностью образовывать комплексные соединения с различными лигандами.
Примерами соединений хрома со степенью окисления 3 могут служить хроматы (CrO42-) и дихроматы (Cr2O72-), которые образуются при взаимодействии хрома с кислородом и различными анионами.
Изменение степени окисления хрома позволяет ему принимать участие в различных реакциях, таких как окисление или восстановление других веществ, а также в образовании разнообразных соединений.
Роль хрома в организмах

Один из основных механизмов действия хрома связан с его влиянием на работу инсулина - гормона, отвечающего за усвоение глюкозы организмом. Хром помогает повысить чувствительность тканей к инсулину, что способствует более эффективному усвоению глюкозы и поддержанию стабильного уровня сахара в крови. Это особенно важно для людей с сахарным диабетом.
Вместе с тем, хром участвует в процессе метаболизма жиров, помогая организму разлагать и использовать их в качестве энергии. Это может способствовать снижению уровня холестерина и предотвращению накопления лишнего веса.
Хром также играет важную роль в регуляции аппетита и насыщения. Он влияет на работу гормонов, отвечающих за чувство голода и сытости, помогая поддерживать нормальный баланс и контролировать аппетит.
Важно отметить, что хром не является жизненно необходимым элементом, однако его недостаток может вызвать различные проблемы со здоровьем, включая нарушения обмена веществ, сахарный диабет типа 2 и проблемы с весом.
Источниками хрома являются такие продукты, как мясо, рыба, яйца, орехи, зерновые культуры и овощи. Однако в больших количествах хром может быть токсичным, поэтому важно соблюдать рекомендованную дозу при его приеме в виде пищевых добавок.