Закон притяжения молекул является одним из фундаментальных законов физики и играет важную роль в понимании поведения вещества. Согласно этому закону, молекулы различных веществ притягиваются друг к другу, что объясняет многие свойства вещества, такие как вязкость, плотность и термическое расширение.
Этот закон основан на том, что все молекулы обладают зарядами, и эти заряды взаимодействуют друг с другом. Существуют два типа взаимодействий между молекулами: притяжение и отталкивание. Притяжение молекул создает силу притяжения между ними, которая приводит к образованию промежутков между молекулами.
Образование промежутков между молекулами является следствием сложного взаимодействия между молекулами и окружающей средой. Эти промежутки имеют важное значение для свойств вещества. Например, вода может находиться в различных фазах (твердая, жидкая, газообразная), а этому способствует наличие различных промежутков между молекулами.
Примером образования промежутков между молекулами является конденсация паров воды. Когда пары воды охлаждаются, их молекулы замедляют свои движения и начинают притягиваться друг к другу. В результате образуются промежутки, и пары воды превращаются в жидкую фазу. Этот процесс также сопровождается выделением тепла, что является следствием высвобождения энергии при притяжении молекул друг к другу.
Как действует закон притяжения молекул?
Закон притяжения молекул описывает явление, которое играет важную роль в формировании промежутков между молекулами вещества. Он основан на силе притяжения, возникающей между молекулами под влиянием межмолекулярных сил.
Каждая молекула содержит заряды разного знака – положительные и отрицательные. Притяжение между зарядами приводит к образованию межмолекулярных связей, которые способны поддерживать молекулы вместе. Наиболее сильным видом межмолекулярных сил является ван-дер-ваальсово взаимодействие.
Ван-дер-ваальсово взаимодействие возникает из-за постоянных диполей в молекулах, вызванных неравномерным распределением электронной плотности. Это приводит к образованию временных диполей и индуцированным дипольным взаимодействиям между молекулами. Ван-дер-ваальсовы силы играют важную роль в образовании промежутков между молекулами и определяют некоторые свойства вещества, такие как температура кипения и твердость.
Закон притяжения молекул отражает сложную силовую структуру, действующую внутри вещества. Этот закон играет важную роль в понимании свойств и поведения вещества, и его изучение позволяет лучше понять химические реакции, фазовые переходы и другие процессы, связанные с молекулярными взаимодействиями.
Сила межмолекулярного взаимодействия
Межмолекулярное взаимодействие играет важную роль в процессе образования промежутков между молекулами. Оно определяет, как молекулы взаимодействуют друг с другом и как они организовываются в материале.
Одной из базовых сил межмолекулярного взаимодействия является сила Ван-дер-Ваальса. Она возникает из-за временно изменяемой поляризации атомов и молекул. В результате этого взаимодействия между молекулами возникает привлекательная сила, которая способствует образованию структуры материала.
Сила Ван-дер-Ваальса может быть разделена на три основных типа: дисперсионные, ориентационные и поляризационные силы. Дисперсионные силы действуют между неполярными молекулами и обусловлены временными перераспределениями электронов вокруг атомов и молекул. Ориентационные силы возникают между полярными молекулами и обусловлены ориентацией дипольных моментов молекул. Поляризационные силы возникают в результате взаимодействия поляризованной молекулы с внешним электрическим полем.
Кроме сил Ван-дер-Ваальса, существуют другие виды межмолекулярных взаимодействий, такие как электростатические взаимодействия, водородные связи и ионные связи. Водородные связи возникают между атомами водорода и электроотрицательными атомами (как кислород, азот и фтор), а ионные связи возникают между положительно и отрицательно заряженными ионами.
Сила межмолекулярного взаимодействия играет ключевую роль в образовании промежутков между молекулами и определяет многие свойства веществ, такие как плотность, температура плавления и прилипательность. Понимание этих взаимодействий помогает улучшить наши знания о свойствах материалов и разработать новые материалы с определенными характеристиками.
| Тип силы | Описание |
|---|---|
| Силы Ван-дер-Ваальса | Силы, возникающие из-за временной поляризации атомов и молекул |
| Электростатические взаимодействия | Силы взаимодействия между заряженными частицами |
| Водородные связи | Особый вид межмолекулярного взаимодействия, возникающий между атомами водорода и электроотрицательными атомами |
| Ионные связи | Силы, возникающие между положительно и отрицательно заряженными ионами |
Виды притяжения молекул
Притяжение между молекулами играет важную роль в образовании и стабильности веществ. В молекулярном мире существуют различные типы притяжения, которые определяют взаимодействия между молекулами:
1. Ван-дер-Ваальсово притяжение: данное притяжение основано на слабых, временных дипольных моментах, которые возникают в неметаллических элементах и неметаллических соединениях. В молекуле небольшими моментами возникают небольшие заряды, которые привлекаются к другим молекулам и образуют слабое притяжение. Хотя силы ван-дер-Ваальса слабы, их накопление может привести к значительной силе притяжения.
2. Дипольное притяжение: это притяжение между молекулами с постоянными дипольными моментами, такими как полярные молекулы. В положительном полюсе одной молекулы притяжение создается к отрицательному полюсу другой молекулы. Дипольное притяжение более сильно, чем ван-дер-Ваальсово притяжение, но все равно слабее химических связей.
3. Гидрофобное взаимодействие: это притяжение между неполярными молекулами, которые не могут взаимодействовать с водой. Это взаимодействие основано на гораздо более слабых силовых взаимодействиях, но оно может быть значительным, особенно в макромолекулярных системах.
4. Ионно-дипольное притяжение: это притяжение между ионами и полярными молекулами. Положительный ион притягивается к отрицательному полюсу полярной молекулы, образуя силовое взаимодействие. Ионно-дипольные взаимодействия являются сильными, но все же слабее ковалентных и ионных связей.
5. Водородная связь: это особый случай дипольного взаимодействия, где атом водорода является "мостиком" между двумя электроотрицательными атомами, такими как кислород, азот или фтор. Водородная связь является одним из наиболее сильных типов притяжения между молекулами и играет важную роль во многих биологических и химических процессах.
Эти виды притяжения образуют промежутки между молекулами, которые определяют физические и химические свойства вещества. Понимание и контроль этих притяжений позволяет нам разрабатывать новые материалы и оптимизировать существующие для различных применений.
Закон притяжения молекул и состояние вещества
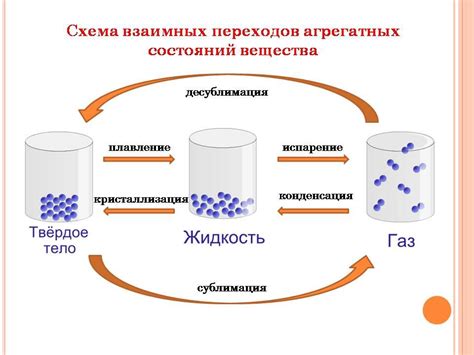
В твердых веществах молекулы сильно притягиваются друг к другу, образуя компактную структуру. Они держатся на определенном расстоянии друг от друга благодаря силам притяжения. Именно поэтому твердые вещества имеют определенную форму и объем.
В жидкостях молекулы меньше притягиваются друг к другу, они более подвижны и свободно перемещаются. Расстояние между молекулами больше, но все же сохраняется сила притяжения. Жидкости имеют определенный объем, но принимают форму сосуда, в котором они находятся.
В газообразных веществах молекулы практически не притягиваются друг к другу. Расстояние между молекулами очень велико, и силы притяжения можно считать пренебрежимо малыми. Газы не имеют ни определенной формы, ни объема, они заполняют весь доступный объем сосуда.
Важно отметить, что сила притяжения между молекулами зависит от многих факторов, таких как масса молекул, расстояние между ними и их электрические свойства. Эти факторы определяют характер притяжения и, как следствие, состояние вещества.
Промежутки между молекулами и свойства вещества
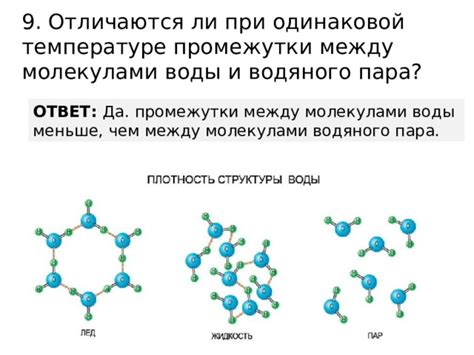
Промежутки между молекулами играют важную роль в определении различных свойств вещества. Эти промежутки формируются благодаря взаимодействию между молекулами, таким как силы притяжения и отталкивания.
Расстояние между молекулами может варьироваться в зависимости от типа вещества и его агрегатного состояния. Например, в газах молекулы находятся на большом расстоянии друг от друга, и их промежутки довольно значительны. В жидкостях молекулы находятся плотнее, но всё же совершают непрерывное движение, что позволяет им находиться друг от друга на определенном расстоянии. В твердых веществах молекулы находятся в плотной упаковке, и промежутки между ними минимальны.
Промежутки между молекулами влияют на такие свойства вещества, как его плотность, теплопроводность и электрические свойства.
- Плотность. Промежутки между молекулами влияют на плотность вещества. Если молекулы находятся близко друг к другу, то вещество будет иметь большую плотность.
- Теплопроводность. Промежутки между молекулами оказывают влияние на способность вещества передавать тепловую энергию. Чем ближе молекулы находятся друг к другу, тем лучше они могут передавать тепло.
- Электрические свойства. Промежутки между молекулами могут также влиять на электрические свойства вещества. Если молекулы находятся на большом расстоянии друг от друга, то вещество будет плохим проводником электричества.
Понимание влияния промежутков между молекулами на свойства вещества является важным для изучения химических и физических процессов, происходящих в природе и в промышленности.
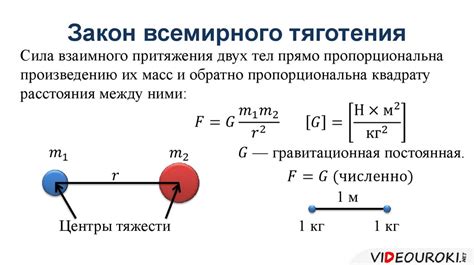
Количественное выражение закона притяжения молекул
Количественное выражение закона притяжения молекул можно записать следующим образом:
- Сила притяжения между двумя молекулами (F) прямо пропорциональна произведению их масс (m1 * m2).
- Сила притяжения обратно пропорциональна квадрату расстояния между молекулами (r^2).
- Математически этот закон записывается как F = G * (m1 * m2) / r^2, где G - гравитационная постоянная.
Когда расстояние между молекулами увеличивается, сила притяжения уменьшается, и молекулы начинают приобретать большую свободу движения. Это приводит к формированию промежутков между молекулами, которые становятся видимыми как объем газа или жидкости. Количественное выражение закона притяжения молекул позволяет описывать и объяснять это явление.
Таким образом, понимание количественного выражения закона притяжения молекул помогает увидеть связь между массой молекул, расстоянием между ними и образованием промежутков вещества.
Полезные последствия притяжения молекул
Притяжение между молекулами имеет ряд полезных последствий, которые влияют на различные аспекты нашей жизни.
1. Связывание атомов. Притяжение между молекулами позволяет атомам объединяться и образовывать более сложные структуры, такие как молекулы. Это явление играет критическую роль в химических реакциях, поскольку структура и свойства вещества зависят от типов связей между атомами.
2. Образование промежутков. Притяжение между молекулами также приводит к образованию промежутков или полостей. Многие материалы, такие как пористые сплавы и губки, могут обладать высокой плотностью отдельных молекул, но иметь низкую плотность в целом благодаря этим промежуткам. Это приводит к улучшению свойств материалов, таких как воздухопроницаемость, теплоизоляция и акустическая изоляция.
3. Конденсация и сгущение. Притяжение между молекулами играет ключевую роль в процессе конденсации и сгущения веществ. При определенных условиях, например, при снижении температуры или повышении давления, молекулы могут притягиваться друг к другу и образовывать жидкость или твердые тела из газообразных веществ. Это имеет большое значение в промышленности, а также в метеорологии, поскольку помогает объяснить образование облаков, дождя и снега.
4. Вязкость и сцепление. Притяжение между молекулами определяет вязкость жидкостей и способность различных материалов сцепляться. Например, высокая вязкость может обеспечить лучшую смазку, а хорошее сцепление может быть полезно для создания прочных связей в различных структурах. Эти свойства могут быть использованы в различных отраслях, таких как автомобильная промышленность, машиностроение и строительство.
Таким образом, полезные последствия притяжения между молекулами играют важную роль в нашей жизни, воздействуя на свойства и поведение материалов, химические реакции и физические процессы.
Факторы, влияющие на притяжение молекул
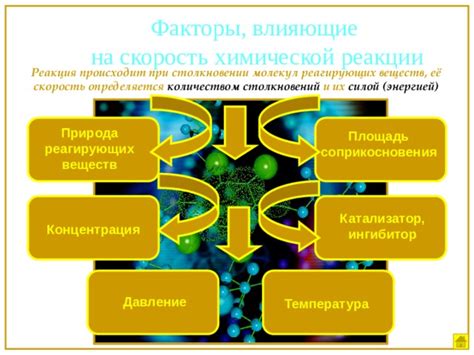
Притяжение между молекулами играет важную роль в формировании промежутков между ними. Это явление зависит от ряда факторов, включая:
- Силу взаимодействия между молекулами. Чем сильнее эти взаимодействия, тем более плотным будет состояние вещества. Например, водородные связи между молекулами воды приводят к образованию густой структуры.
- Величину молекулярных масс. Чем больше масса молекул, тем больше вероятность, что пространство между ними будет меньше.
- Температуру. При повышении температуры молекулы получают больше энергии и двигаются быстрее. Это может привести к увеличению промежутков между ними.
- Давление. При повышении давления молекулы сближаются друг с другом, что может уменьшить промежутки между ними.
- Растворители. Некоторые вещества могут влиять на притяжение между молекулами. Например, добавление растворителя может повысить силу взаимодействия и уменьшить промежутки между молекулами.
Все эти факторы влияют на формирование промежутков между молекулами и определяют свойства вещества. Изучение этих факторов позволяет лучше понять особенности взаимодействия молекул и сформировать более точные модели поведения вещества.
Как управлять промежутками между молекулами?
Закон притяжения молекул играет важную роль в формировании промежутков между ними. Однако, в определенных случаях, необходимо управлять этим процессом для достижения определенных целей. Вот несколько способов, которые могут помочь в этом:
1. Температура:
Изменение температуры может оказывать влияние на притяжение между молекулами. Повышение температуры приводит к увеличению кинетической энергии молекул, что отталкивает их друг от друга. В то же время, понижение температуры способствует усилению притяжения молекул и сжатию промежутков между ними.
2. Изменение давления:
Воздействие давления на молекулы также влияет на притяжение между ними. Повышение давления обычно приводит к уменьшению объема и сжатию промежутков между молекулами. Снижение давления, напротив, способствует расширению промежутков.
3. Применение электромагнитных полей:
Использование электромагнитных полей может быть эффективным способом управления промежутками между молекулами. Например, сильные электромагнитные поля могут временно разделять молекулы и создавать промежутки между ними.
Управление промежутками между молекулами имеет широкий потенциал для различных областей, включая химию, физику и материаловедение. Понимание этих механизмов и возможности управления является важным шагом к развитию новых материалов и технологий.